那些病毒包装中的秘密,你造么?
信息来源:金开瑞 作者:genecreate 发布时间:2017-06-22 09:17:14
一、操作安全性
(1)可在生物安全柜、常规超净工作台(不开启排风机)中进行慢病毒使用操作;
(2)操作者须穿着实验服,戴口罩、一次性手套,谨防毒液直接接触眼耳鼻口或皮肤伤口;
(3)操作过程注意避免毒液飞散、滴洒,注意勿被锐利器材、针头等划破皮肤;
(4)不慎直接接触毒液的操作台、需回收器材,可通过0.25% SDS、70%乙醇、1%次氯酸钠等溶液灭活病毒;
(5)使用过的工作台面、显微镜载物台等经70%乙醇擦拭;
(6)培养器皿、枪头等废弃物应84消毒液(1:9稀释)浸泡,或121℃高温消毒,方可丢弃。
二、慢病毒的保存
(1)慢病毒载体经过干冰运输,在-80℃可保存6个月,保存超过6个月时需重新摸索工作滴度。
(2)冻存的毒液在使用前置于冰上或4℃融化,最好于当天用完,未用完的毒液可暂时保存于4℃,不超过2天。
(3)反复冻融会严重降低慢病毒滴度,每次冻融可降低20%以上,建议在初次使用时按用量进一步小量分装冻存。
(1)可在生物安全柜、常规超净工作台(不开启排风机)中进行慢病毒使用操作;
(2)操作者须穿着实验服,戴口罩、一次性手套,谨防毒液直接接触眼耳鼻口或皮肤伤口;
(3)操作过程注意避免毒液飞散、滴洒,注意勿被锐利器材、针头等划破皮肤;
(4)不慎直接接触毒液的操作台、需回收器材,可通过0.25% SDS、70%乙醇、1%次氯酸钠等溶液灭活病毒;
(5)使用过的工作台面、显微镜载物台等经70%乙醇擦拭;
(6)培养器皿、枪头等废弃物应84消毒液(1:9稀释)浸泡,或121℃高温消毒,方可丢弃。
二、慢病毒的保存
(1)慢病毒载体经过干冰运输,在-80℃可保存6个月,保存超过6个月时需重新摸索工作滴度。
(2)冻存的毒液在使用前置于冰上或4℃融化,最好于当天用完,未用完的毒液可暂时保存于4℃,不超过2天。
(3)反复冻融会严重降低慢病毒滴度,每次冻融可降低20%以上,建议在初次使用时按用量进一步小量分装冻存。
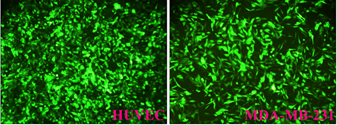
三、慢病毒包装常见问题及预防
1、不宜使用polybrene的常见细胞系
Polybrene可以通过中和细胞表面糖蛋白唾液酸残基所带电荷起到增加慢病毒感染效率的作用。但对一些细胞具有明显细胞毒性,若使用反而影响实验效果。这些细胞有例如:HSC-T6(大鼠肝星型细胞),Raw264.7(小鼠单核巨噬细胞白血病细胞),MCF-7(人乳腺癌细胞),H929(人多发性骨髓瘤细胞),GBC-SD(人胆囊癌细胞株),NB4(人白血病细胞株),kasumi(人白血病细胞株),Jurkat(人白血病细胞株),等。建议在开始实验前查阅相应文献报道,以及参考的polybrene工作浓度。
2、过表达不成功的可能原因
(1)质粒构建有一定的问题。
(2)由于序列具有特殊结构导致转录困难、mRNA十分不稳定等情况下,可导致mRNA水平无法显著过表达。在排除质粒构建问题之后,先通过q-PCR验证目的基因在mRNA水平的过表达,可以同时使用293T等易表达细胞作为对照。
(3)如果mRNA水平能够过表达,可能由于存在翻译后修饰、密码子构成、翻译效率、蛋白快速降解等因素,导致蛋白水平过表达不显著。同时,使用WB进行蛋白水平分析时,需要设置阳性对照,对实验条件,尤其是抗体进行验证。
3、如何提高病毒感染效率
除了提高MOI以外,还可以从其他角度尝试改善感染效率。
(1)适当减小孵育培养基体积(加入病毒量不变),可增大病毒密度,有利于提高感染效率。减小体积孵育时需考虑对细胞状态、换液时间的影响。例如,96孔板(50ul),24孔板(250ul),6孔板(1ml),小体积孵育4h,然后补液至正常培养体积,继续培养24h后换液。
(2)适当延长孵育时间。如延至24 h再换液,注意需要兼顾细胞状态,主要适用于原孵育时间较短(如4-6 h)时。因为慢病毒在37℃半衰期约8小时,所以一味延长孵育时间效用并不明显。
(3)Polybrene对于很多细胞可提高感染效率,但同时也存在细胞毒性,对部分类别细胞(如神经元、DC细胞)毒性较大而不宜使用。当MOI低于20时,也没有添加Polybrene的必要。具体细胞的Polybrene使用浓度可参考文献报道,以及通过预实验确定。通常在4-10 ug/ml范围。Protamine sulfate作为Polybrene替代物对部分细胞毒性较小。
(4)如果有可离心孔板的平角离心转头,可以2200rpm边离心边感染2 h(37℃),然后继续置于培养箱中按标准条件孵育培养。该方式对于悬浮细胞的感染尤为有益。
(5)如果细胞状态允许,可进行重复感染。孵育结束后更换不含病毒的完全培养基,培养16-24 h后,重复感染过程1-2次,可提高感染效率。
最新动态
-
04.22
一文读懂EMSA技术核心要点,让“emsa” 秒变“easy”
-
04.02
4·2世界孤独症日 | 聆听“星”声“泌”语,让爱来,让碍走
-
04.01
酵母杂交核心技术:深度Q&A帮你轻松突破实验瓶颈
-
03.19
【客户文献解读,IF>11】食管癌的"隐形推手":MALR-ILF3-HIF1a轴的强大作用
-
03.18
siRNA介绍及药物研发的现状前景
-
03.18
知无不“研”|5篇高分文献带你一览高通量酵母杂交的非凡魅力~
-
02.27
【客户文章分享】SHMT2 通过 5′UTR 依赖性 ADAM10 翻译启动介导小分子诱导的阿尔茨海默病病理学缓解过程
-
01.24
客户文献解读 | 中医为什么能治流感?是玄学还是运气?INT J NANOMED揭示鱼腥草抗病毒机制及范围!
-
01.24
客户文献分享,IF>11|Shank3:脑缺血再灌注损伤的守护者,揭示神经保护的新篇章
-
12.27
文献解读 | 高密度脂蛋白通过miR-181a-5p调控自噬影响血管新生










