应用定量蛋白质组学分析SEMA3B-AS1抑制人骨髓间充质干细胞成骨分化机制
信息来源:金开瑞 作者:genecreate 发布时间:2018-07-16 17:18:47
客户文章分享:应用定量蛋白质组学分析SEMA3B-AS1抑制人骨髓间充质干细胞成骨分化机制
题目:SEMA3B-AS1-inhibited osteogenic differentiation of human mesenchymal stem cells revealed by quantitative proteomics analysis.
期刊:journal of cellular physiology
影响因子:3.923
研究背景及思路:
常见的非编码RNA包括lncRNA、circRNA、miRNA,在细胞的生长、增殖、分化、凋亡中具有重要的调控作用。研究发现,非编码RNA与肿瘤的发生、发展、转移密切相关。作为非编码RNA的一员,lncRNA已被证实广泛在各类肿瘤的发生发展中扮演重要角色。
新骨形成被认为是治疗骨相关疾病的一种新型的可替代方法,例如骨质疏松、骨架变形、骨折等。许多研究旨在提高新骨形成过程以希望治愈这些疾病。骨髓间充质干细胞(hMSC)是具有分化为成骨细胞、软骨细胞展现多种分化潜能的成纤维样多能干细胞,在新骨形成过程和骨质疏松发病等过程中发挥重要的作用。
长链非编码RNA(lncRNAs)被发现参与成骨分化及骨质疏松的过程,比如H19通过吸附miRNA-675促进成骨细胞分化,MEG3通过靶向BMP4或者miR-140-5p来提高MSC的骨生成。但是lncRNA参与hMSC分化过程以及具体的机制目前不是很清楚。
hMSC的分化是接受不同环境刺激后发生的过程,细胞表面受体在这个过程中发挥重要的作用,可以起到信号级联及放大的作用。SEMA家族蛋白被发现在骨生成或者骨疾病中发挥作用。如Sema6d、mema4d、sema3a等被发现可以平衡破骨细胞和成骨细胞来调节骨形成和骨吸收。
前期研究发现SEMA3B-AS1可以抑制hMSC的增殖和骨分化,但是具体机制需要研究。目前研究lncRNA的手段主要有:① 功能、表型、疾病性相关研究;②组学技术分析研究lncRNA的差异表达、寻找预测新的lncRNA、生物信息分析lncRNA的靶基因;③ 利用互作技术及质谱技术寻找及验证与lncRNA结合的RNA及蛋白等。肿瘤等疾病中lncRNA作用机制的研究有望为疾病的治疗寻找到新的靶点。
本研究主要采用蛋白组学技术(iTRAQ)研究反义lncRNA-SEMA3B-AS1的作用机制。部分结果及分析如下:
研究内容及结果:
1. MTT法检测细胞增殖和茜素红S染色实验证实SEMA3B-AS1可以抑制细胞的增殖(a)和向成骨转化(b)。说明SEMA3B-AS1具有抑制人骨髓间充质干细胞增殖和向成骨分化的功能作用。
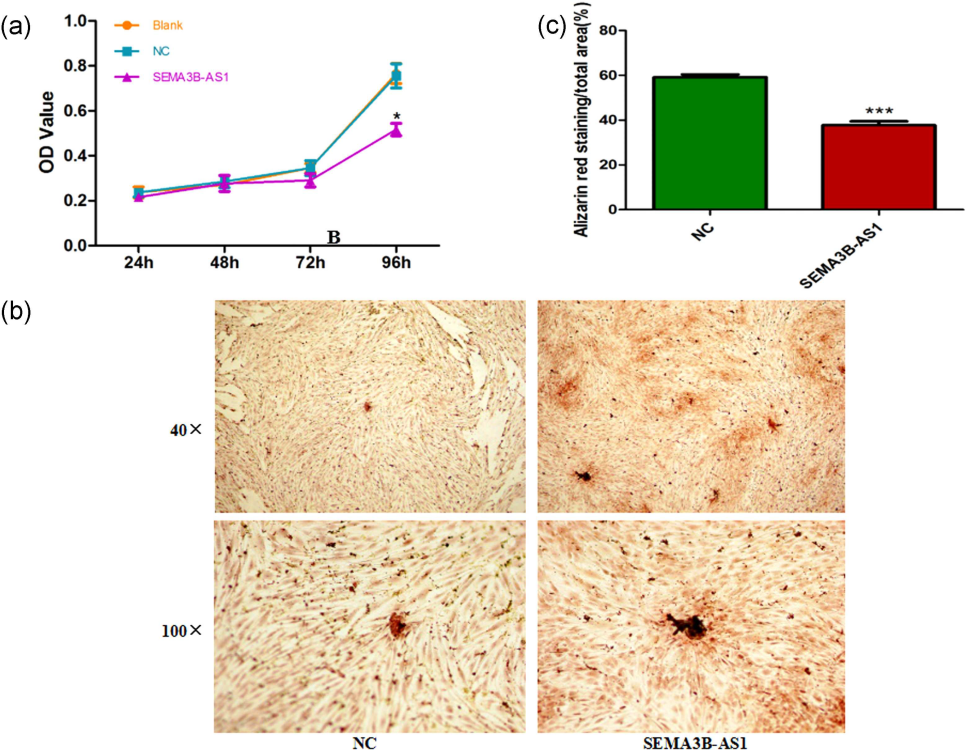
图1. SEMA3B-AS1对细胞增殖和成骨分化的影响
2. 上述功能验证实验已经确定了SEMA3B-AS1对人骨髓干细胞的增殖和分化产生了影响。但是SEMA3B-AS1通过何种途径发挥功能呢?
作者接着包装SEMA3B-AS1过表达慢病毒,采用蛋白组学技术(iTRAQ)检测过表达SEMA3B-AS1和空载体的两个细胞组中差异蛋白的变化。通过对差异蛋白做了聚类和功能富集,发现SEMA3B-AS1可能通过上调或者下调相关基因来影响肌动蛋白骨架、黏着斑、胞外基质与受体的相互作用,来调节细胞的骨生成,进而影响细胞的增殖和分化。
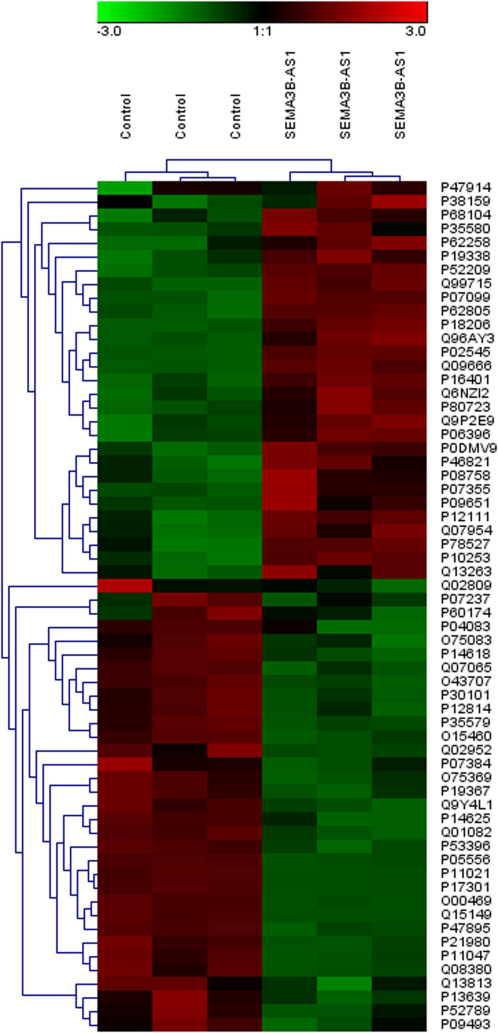
图2. SEMA3B-AS1过表达组和空载体组中差异基因的聚类图
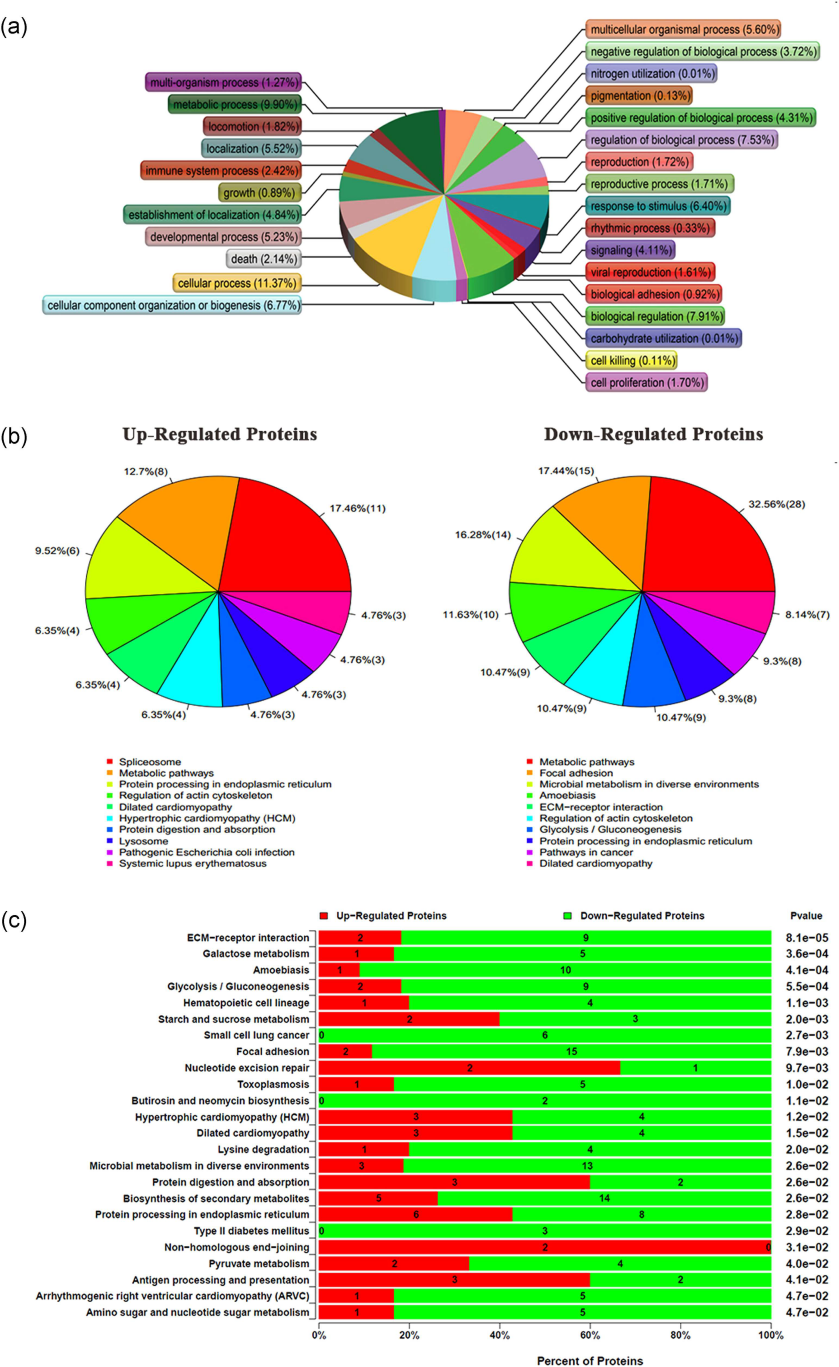
图3. 功能富集和差异蛋白表达分析
这样,整篇文章的思路出来了。功能实验验证SEMA3B-AS1对细胞增殖和分化的作用,蛋白组学技术研究探讨SEMA3B-AS1发挥作用的可能途径,由功能到机制的探讨研究。诠释反义lncRNA(SEMA3B-AS1)可以通过某些途径抑制hMSC的增殖和骨分化,为骨质疏松的治疗提高靶点参考。
研究小结:
借鉴可取之处:lncRNA分为正义lncRNA和反义lncRNA,同正义lncRNA相比,反义lncRNA由于与正义链互补,反义链lncRNA与相邻或者相近的基因的调控关系更加密切。首先,作者取道反义lncRNA,以骨质疏松发病机制研究为目的,以人骨髓间充质干细胞、反义lncRNA(SEMA3B-AS1)为对象,功能实验检测了SEMA3B-AS1对细胞增殖和骨生成的影响。同时,作者采用蛋白组学技术(iTRAQ)检测分析受SEMA3B-AS1调控的蛋白的差异表达以及差异蛋白的生物学过程及相关的代谢通路。最后,作者分析了SEMA3B-AS1调节的骨生成在骨质疏松发生中的作用,得出SEMA3B-AS1可能是骨质疏松治疗的一个靶点。
不足遗憾之处:基因选取得比较好,但是文章在组学上做得比较常规;虽然做了过表达SEMA3B-AS1后相关的细胞功能验证,但深度还不够;其次,本文作者猜测SEMA3B-AS1可以调控临近的SEMA3A(B)的表达,但可惜没有做进一步的验证;如果文章作者能够进一步运用pulldown或者RIP互作技术(结合质谱),找出互作分子,文章亮点更足,内容更翔实。
解析文献:
Chen Zhang, Yun Zhu, et al. SEMA3B-AS1-inhibited osteogenic differentiation of human mesenchymal stem cells revealed by quantitative proteomics analysis. journal of cellular physiology, DOI: 10.1002/jcp.26776.
参考文献:
[1] J.C. Chen, C.R. Jacobs, Mechanically induced osteogenic lineage commitment of stem cells, Stem Cell Res Ther, 4 (2013) 107.
[2] J.J. Quinn, H.Y. Chang, Unique features of long non-coding RNA biogenesis and function, Nat Rev Genet, 17 (2016) 47-62.
[3] C. Sang, Y. Zhang, F. Chen, P. Huang, J. Qi, P. Wang, Q. Zhou, H. Kang, X. Cao, L. Guo, Tumor necrosis factor alpha suppresses osteogenic differentiation of MSCs by inhibiting semaphorin 3B via Wnt/beta-catenin signaling in estrogen-deficiency induced osteoporosis, Bone, 84 (2016) 78-87.
[4] P.S. Mathieu, E.G. Loboa, Cytoskeletal and focal adhesion influences on mesenchymal stem cell shape, mechanical properties, and differentiation down osteogenic, adipogenic, and chondrogenic pathways, Tissue Eng Part B Rev, 18 (2012) 436-444.
1. J.C. Chen, C.R. Jacobs, Mechanically induced osteogenic lineage commitment of stem cells, Stem Cell Res Ther, 4 (2013) 107.
2. J.J. Quinn, H.Y. Chang, Unique features of long non-coding RNA biogenesis and function, Nat Rev Genet, 17 (2016) 47-62.
3. C. Sang, Y. Zhang, F. et al , Tumor necrosis factor alpha suppresses osteogenic differentiation of MSCs by inhibiting semaphorin 3B via Wnt/beta-catenin signaling in estrogen-deficiency induced osteoporosis, Bone, 84 (2016) 78-87.
4. P.S. Mathieu, E.G. Loboa, Cytoskeletal and focal adhesion influences on mesenchymal stem cell shape, mechanical properties, and differentiation down osteogenic, adipogenic, and chondrogenic pathways, Tissue Eng Part B Rev, 18 (2012) 436-444.
最新动态
-
03.19
【客户文献解读,IF>11】食管癌的"隐形推手":MALR-ILF3-HIF1a轴的强大作用
-
03.18
siRNA介绍及药物研发的现状前景
-
03.18
知无不“研”|5篇高分文献带你一览高通量酵母杂交的非凡魅力~
-
02.27
【客户文章分享】SHMT2 通过 5′UTR 依赖性 ADAM10 翻译启动介导小分子诱导的阿尔茨海默病病理学缓解过程
-
01.24
客户文献解读 | 中医为什么能治流感?是玄学还是运气?INT J NANOMED揭示鱼腥草抗病毒机制及范围!
-
01.24
客户文献分享,IF>11|Shank3:脑缺血再灌注损伤的守护者,揭示神经保护的新篇章
-
12.27
文献解读 | 高密度脂蛋白通过miR-181a-5p调控自噬影响血管新生
-
12.27
16分+SCI【客户文章】Nature子刊:鞠怀强/徐瑞华团队揭示FGL1促进转移性结直肠癌免疫逃逸和进展的机制
-
12.13
Science子刊:肠道靶向纳米颗粒可针对产气荚膜梭菌感染提供特异性靶向抗菌肽
-
11.28
医生说:一天一个苹果 ,有没有理论依据?










