肽键的稳定性案例个人解读
信息来源:金开瑞 作者:genecreate 发布时间:2018-07-18 15:03:12
前两天一个北京的朋友问到肽键的稳定性问题,他想知道在还原剂的条件下肽键是不是不稳定,因为他的蛋白在非还原电泳中是28kDa, 以及部分14kDa, 在还原性电泳中是14kDa的均一条带。今天借朋友的图来说一下肽键的稳定性。
(1)蛋白质的耐热性能和一级结构关系不大,更多的都是在高温下,高级结构破坏疏水面暴露以后,聚集沉淀。比如一个鸡蛋,即使咱们做成了鸡蛋花汤,如果用SDS-loading buffer 溶解以后,大部分蛋白的都还保持一级结构的完整性。
(2)但是(1)这个说法并不严格,我们知道煲汤的时候,只要时间到位了,汤就可以变的鲜美,这事实上是蛋白质多肽链的水解,释放出氨基酸以及其它一些小分子的原因。也就是说蛋白质的肽链只要煮的足够久,最终也会被打断,温度越高降解的越快(中国式油煎蛋就比西方的冷锅扒蛋要味道好)。
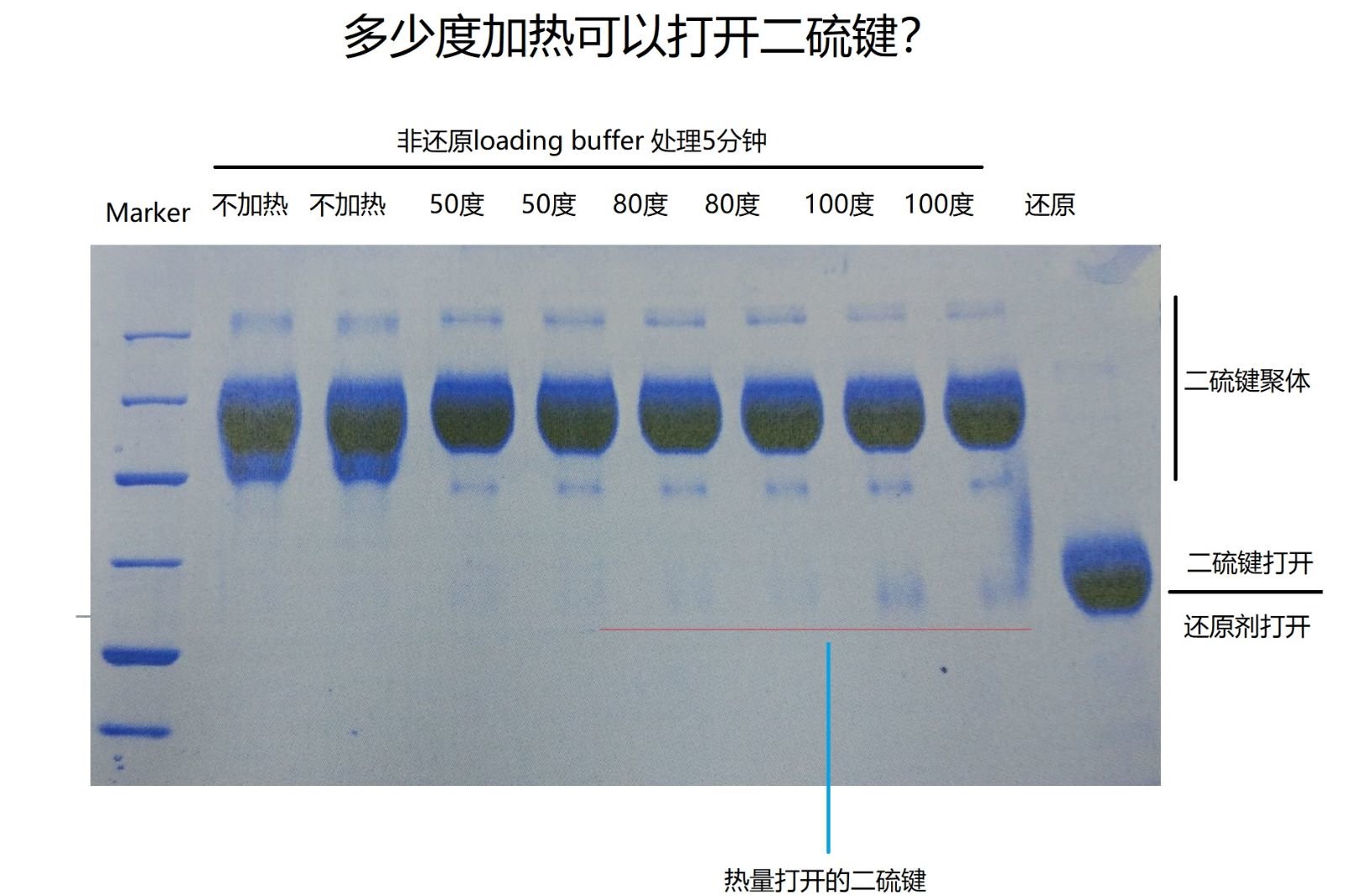
(3)通常情况下肽键要比二硫键要稳定。下面这个图显示了,在没有还原剂的情况下50度,80度,100度煮样5分钟,都可以造成部分二硫键的打开,温度越高打开比例越多。可见,即使在100度的非还原loading buffer中,二硫键的打开速度还是挺慢的,肽键断裂的速度也就更慢了,在下图中,基本上五法看到肽键的水解组分。
(4)许多实验室sds电泳样品处理条件是:98-100度煮3-5分钟,我们通过下图可以知道,在这个条件下,蛋白的肽链还是稳定的。且大部分情况下,80度加热和100度加热并没有多少条带上的差异。但是为何有人的电泳就结果很漂亮,条带很sharp, 有些人的电泳就很糊呢?
(5)下图的最后一个lane说明在还原剂中,5分钟煮样可以完全打开二硫键,但是如果你的还原剂质量差,那么会出现还原剂和蛋白之间发生再次交联,也就是已经寡聚的还原剂和蛋白质上的巯基再次交联在一起,此时的交联是非特异的,条带就会变糊。这就是为何我反复和兄弟们说还原剂要用TCEP的原因。
(6)当然,电泳糊还有很多其它原因,比如你用的甘氨酸,tris体系里面的纯度。有些实验室喜欢重复回收使用甘氨酸running buffer, 其实完全没有必要。通常用来电泳的甘氨酸质量已经不太好,室温放置很容易变粘(具体原因我也不清楚),这样的缓冲液结果不会好。太差的甘氨酸里面杂质太多,在电泳胶的上端压缩胶中的时候就有问题,进入分离胶就会出现离子对不平衡,扩散的厉害。这个就不深入讨论了。
(7)最后,祝大家好好煲汤,只有汤做的好,电泳才能做的好,因为原理大约雷同。一个好厨师,也一定可以成为一个好的蛋白纯化大师。
最新动态
-
03.19
【客户文献解读,IF>11】食管癌的"隐形推手":MALR-ILF3-HIF1a轴的强大作用
-
03.18
siRNA介绍及药物研发的现状前景
-
03.18
知无不“研”|5篇高分文献带你一览高通量酵母杂交的非凡魅力~
-
02.27
【客户文章分享】SHMT2 通过 5′UTR 依赖性 ADAM10 翻译启动介导小分子诱导的阿尔茨海默病病理学缓解过程
-
01.24
客户文献解读 | 中医为什么能治流感?是玄学还是运气?INT J NANOMED揭示鱼腥草抗病毒机制及范围!
-
01.24
客户文献分享,IF>11|Shank3:脑缺血再灌注损伤的守护者,揭示神经保护的新篇章
-
12.27
文献解读 | 高密度脂蛋白通过miR-181a-5p调控自噬影响血管新生
-
12.27
16分+SCI【客户文章】Nature子刊:鞠怀强/徐瑞华团队揭示FGL1促进转移性结直肠癌免疫逃逸和进展的机制
-
12.13
Science子刊:肠道靶向纳米颗粒可针对产气荚膜梭菌感染提供特异性靶向抗菌肽
-
11.28
医生说:一天一个苹果 ,有没有理论依据?










