TMT+Label-free揭示细胞衰老分子机制
信息来源:金开瑞 作者:genecreate 发布时间:2018-12-12 09:56:54
题目:Cell-specific proteome analyses of human bone marrow reveal molecular features of age-dependent functional decline
蛋白质组学揭示细胞衰老分子机制
期刊:Nature Communications
影响因子:12.353
主要技术:TMT,Label free
研究背景
组织和器官老化的根本原因是干细胞的老化,随着年龄的增长,造血干细胞数量和功能发生显著变化。转录组学在少数细胞群中的相关研究已经提供了潜在证据表明,这些变化和细胞衰老息息相关,但是对内在机制仍然缺乏系统性研究。因此,作者希望能够系统了解人类造血干细胞和祖细胞(HPC)衰老所涉及的分子机制,提供骨髓细胞网络内人类衰老过程的蛋白质组学特征图谱。
研究内容及结果
1. 蛋白质组学分析
作者选择了59名志愿者,年龄在20-60岁之间,包括45名男性和14名女性,抽取骨髓样本进行细胞分离,获得六种细胞群:HPC、LYM(淋巴细胞和前体)、MON(单核细胞/巨噬细胞和前体)、GRA(粒细胞前体)、ERP(红细胞前体)、MSC(间充质干细胞/wd基质细胞)(图1a-b)用于后续蛋白质组学分析。
为了同时评估与空间(细胞群)和时间(老化)变化衰老相关的分子变化,作者选择使用两种定量蛋白质组学技术——TMT和Label free,对上述六种细胞群进行组学分析(图1c),共鉴定到12158种蛋白质(图1d-e)。通过相应亚群的已知细胞类型特异性标记的丰度谱进一步证实了数据集的可靠性(图2a),并基于其分离相应的细胞类型,验证分析表明,蛋白质组学数据集是可靠的,可以解决跨细胞群的年龄依赖性差异问题。
作者发现,绝大多数(73.3%)定量蛋白存在于一个以上的细胞群中,其中18.6%在六个亚群中同时存在,这种核心蛋白质组具有基本的管家功能,但它们的丰度在不同的细胞群中不同,特别是在代谢途径中(图2c)。总的来说,核心蛋白质组的不同表达丰度可以区分6个不同的细胞群(图2b)。
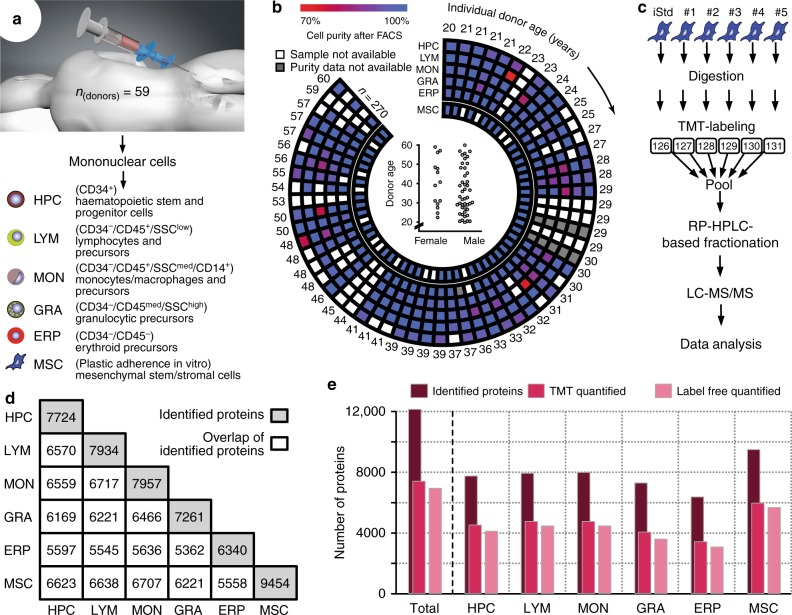
图1 蛋白质组学实验设计
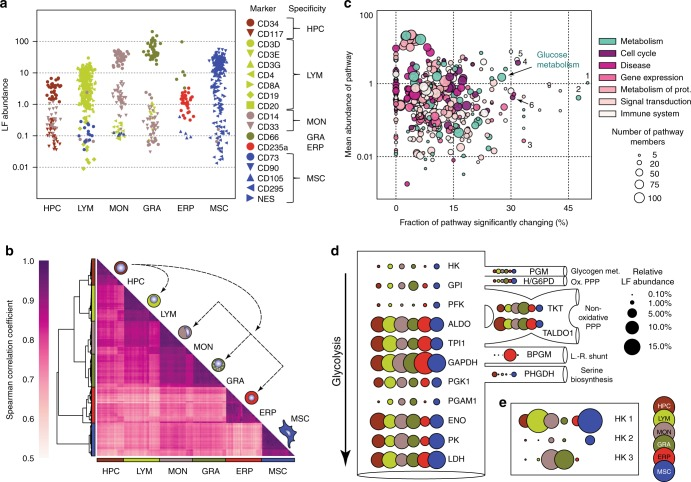
图2 蛋白质组学分析结果
2. 衰老对蛋白质组表达谱的影响
为了研究衰老与蛋白表达变化之间的关系,作者对组学数据进行Spearman's相关性分析,发现衰老与许多蛋白质显著表达变化相关,而且这些差异表达蛋白与性别无关。此外,不同年龄相关的数据集仅在部分重叠,表明年龄对不同的细胞类型有明显的影响。这可能反映了所研究的六个细胞群的不同半衰期。
随后作者基于Reactome数据库进行通路分析(图3a),揭示了显著的细胞类型特异性和年龄相关的蛋白质丰度变化。此外,作者也找到了一些在转录组层面报道的衰老标志物,如随着HPC老化,干扰素调节因子8(IRF8)和DNA甲基转移酶1(DNMT1)表达量显著下调。
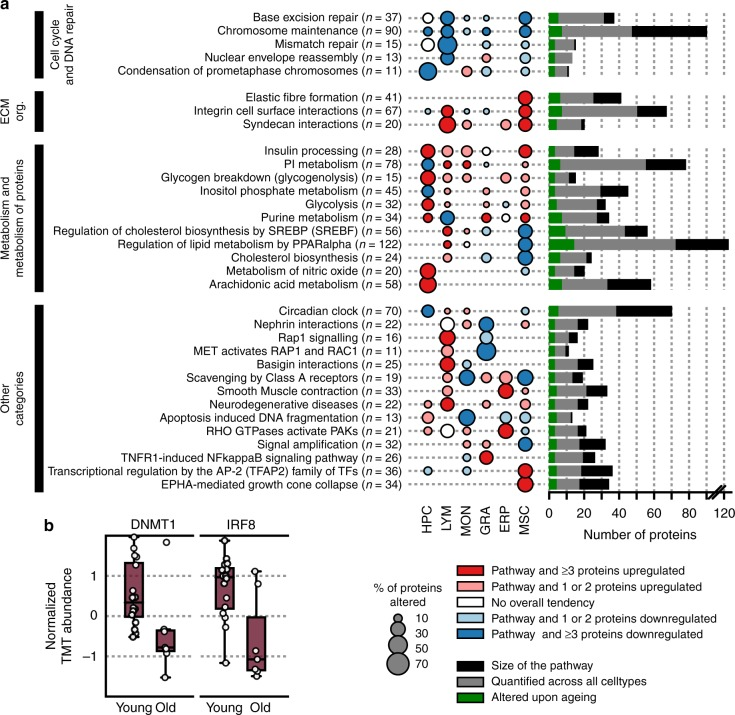
图3 不同细胞群中与衰老相关的通路分析
3. 衰老影响HPC碳代谢
作者发现,HPC蛋白质的糖酵解途径中,糖原分解代谢和脂肪酸β-氧化(FAO)中起重要作用的酶的差异表达与衰老密切相关。这些差异表达蛋白表明老年HPC与年轻HPC相比,代谢活性和特异性代谢合成活性增强(图4),这是其他五个细胞群所没有的。值得注意的是,这些蛋白差异表达变化仅影响消耗ATP并将葡萄糖转化为磷酸二羟丙酮和3-磷酸D-甘油醛的糖酵解途径的准备阶段,以ATP、烟酰胺腺嘌呤二核苷酸(NADH)和丙酮酸以及TCA循环的产生为特征的第二阶段基本上不受影响(图4a)。与老化合成代谢趋势一致,HPCs的代谢组学分析(n = 10,年龄:21-69岁)显示磷酸戊糖途径中的两种代谢物,5-磷酸核酮糖和5-磷酸核酸在老年HPC中积累的趋势(图4b)。总体而言,在HPC中,衰老与中枢代谢途径的重新布线和代谢中间体的重新布线相关,用于合成代谢过程和表观遗传过程中重要的辅因子。
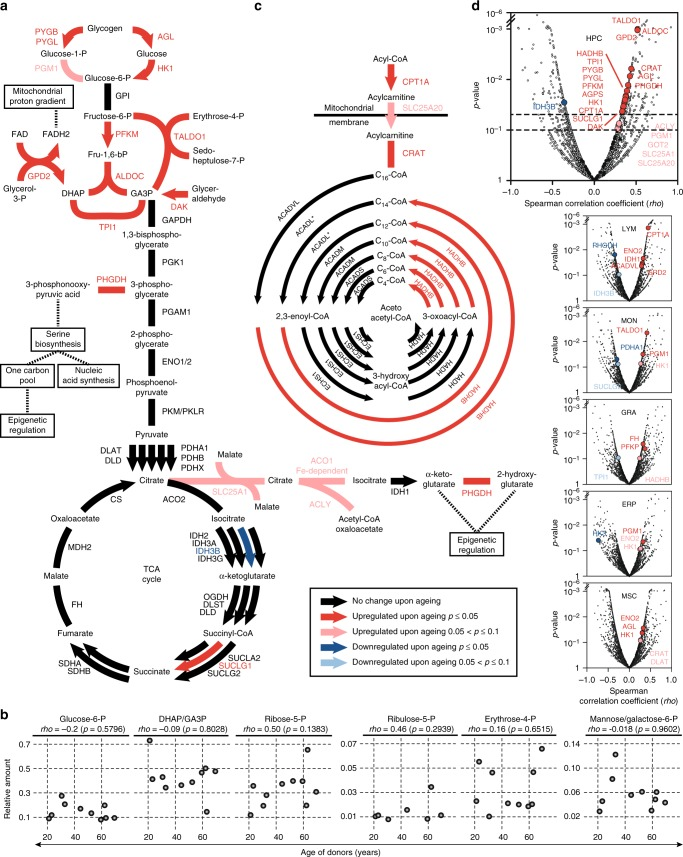
图4 衰老后碳代谢变化
4. 衰老时骨髓相对于淋巴样分化较高
作者在HPC群体中发现了17种显著差异蛋白质,这些蛋白质参与维持多能性或沿着髓系或淋巴谱系的分化。为了表征HPC与年龄相关的功能衰减,作者随后分析了这些蛋白质丰度随时间变化的动态变化(图5a),发现随着HPC衰老,两种与淋巴发育和功能直接相关的蛋白质DNTT和BCL11A的表达显著下调,异二聚体可溶性鸟苷酸环化酶(GUCY1A3和GUCY1B3),即一氧化氮(NO)的下游信号传导效应物,这两种蛋白的表达显著上调。环鸟苷酸通路信号传导能够调节造血功能,可能表明分化倾向于髓系。与淋巴细胞分化相关的蛋白如MME、IKZF1和EBF1随着年龄增加表达量显著下调(图5b)。形成鲜明对比的是,与骨髓谱系相关的蛋白质如PTGS1、PSTPIP2和TBXAS1,随着年龄增加表达量显著上调(图5c)。总之,作者证明了参与淋巴发育的蛋白质丰度显著降低,随着HPC变老,与髓细胞和血小板分化相关的因子大量增加。
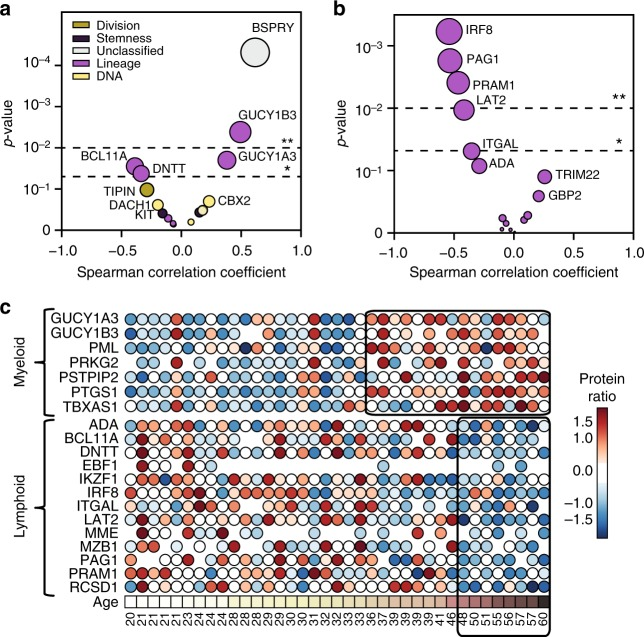
图5 HPCs中差异表达蛋白随衰老的变化
研究小结
作者利用TMT和Label free两种定量蛋白质组学技术,研究衰老过程中HPC细胞群分化与功能衰退以及对骨髓分化的偏向,发现随着HPC的衰老变化,中心碳代谢途径特别是糖酵解途径发生显著改变,揭示衰老导致骨髓生态位的改变,并削弱了HPC归巢所涉及的途径的功能。
解析文献
Marco L. Hennrich, Natalie Romanov, et al. Cell-specific proteome analyses of human bone marrow reveal molecular features of age-dependent functional decline. Nature Communications, 2018, 9: 4004.
参考文献
1. Thompson, A. et al. Tandem mass tags: a novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS. Anal. Chem.2003, 75, 1895–1904.
2. Shyh-Chang, N., Daley, G. Q. & Cantley, L. C. Stem cell metabolism in tissue development and aging. Development, 2013, 140, 2535–2547.
3. Wilhelm, M. et al. Mass-spectrometry-based draft of the human proteome.Nature, 2014, 509, 582–587.
4. Uhlen, M. et al. Proteomics. Tissue-based map of the human proteome.Science, 2015, 347, 1260419 .
5. Ori, A. et al. Integrated transcriptome and proteome analyses reveal organspecific proteome deterioration in old rats. Cell Syst. 2015, 1, 224–237.
6. Szklarczyk, D. et al. The STRING database in 2017: quality-controlled proteinprotein association networks, made broadly accessible. Nucleic Acids Res. 2017, 45, D362–D368.
Label-free是通过比较质谱分析次数或质谱峰强度,分析不同来源样品蛋白的数量变化,认为肽段在质谱中被捕获检测的频率与其在混合物中的丰度成正相关。因此,蛋白质被质谱检测的计数反映了蛋白质的丰度,通过适当的数学公式可以将质谱检测计数与蛋白质的量联系起来,从而对蛋白质进行定量。
TMT是一种多肽体外标记技术,TMT试剂通过反应基团能够高效地标记酶解后的肽段。在一级质谱图中,分子量标准化基团使任何一种TMT试剂标记的不同样本中的同一肽段表现为相同的质荷比。在串联质谱中,报告基团优先断裂,释放报告离子。每个报告离子都有各自独特的分子量,并且能够在MS/MS分析中反应出所标记的多肽的样品丰度,根据报告离子的信号强度值可获得样品间相同肽段的定量信息,再经过软件处理得到蛋白质的定量信息。
适用范围
药物作用靶点研究
疾病标志物筛选
植物胁迫/抗逆研究
作用机制研究
物种蛋白质草图构建
要求物种含有已完成全基因组测序或转录组测序注释的CDS信息
上一条:GFP抗体应用及常见问题解答
下一条:病毒鉴定的方法有哪些?
最新动态
-
04.22
一文读懂EMSA技术核心要点,让“emsa” 秒变“easy”
-
04.02
4·2世界孤独症日 | 聆听“星”声“泌”语,让爱来,让碍走
-
04.01
酵母杂交核心技术:深度Q&A帮你轻松突破实验瓶颈
-
03.19
【客户文献解读,IF>11】食管癌的"隐形推手":MALR-ILF3-HIF1a轴的强大作用
-
03.18
siRNA介绍及药物研发的现状前景
-
03.18
知无不“研”|5篇高分文献带你一览高通量酵母杂交的非凡魅力~
-
02.27
【客户文章分享】SHMT2 通过 5′UTR 依赖性 ADAM10 翻译启动介导小分子诱导的阿尔茨海默病病理学缓解过程
-
01.24
客户文献解读 | 中医为什么能治流感?是玄学还是运气?INT J NANOMED揭示鱼腥草抗病毒机制及范围!
-
01.24
客户文献分享,IF>11|Shank3:脑缺血再灌注损伤的守护者,揭示神经保护的新篇章
-
12.27
文献解读 | 高密度脂蛋白通过miR-181a-5p调控自噬影响血管新生










