柱层析蛋白质纯化方法学介绍
信息来源:金开瑞 作者:genecreate 发布时间:2019-01-15 11:02:39
柱层析设备
柱层析的基本原理是将一份蛋白质混合物分成很多小份,从而使某些组分中目标蛋白的浓度通过浓缩得以增大。虽然已经有很多昂贵和特殊的设备可用于柱层析,但实际上它只需要最基本的设备即可。
基本柱层析设备
固定相:一种惰性介质, 通常带有一种可促进蛋白质相互作用的官能团以进行蛋白质分离。固定相和官能团的选择取决于层析色谱和方法的种类。
柱子:一种圆柱形玻璃容器,长度和直径各不相同。柱子可以直接购买已填装固定相能直接连接到层析设备上使用的预装柱(参见本章第2部分),或可购买空柱自己手动填装。自动层析设备和人工重力柱使用的是不种类型的柱子。
溶剂:含有添加剂的缓冲液,作为将蛋白质在固定相上平衡和洗脱的流动相。不同类型的柱层析需要不同的溶液条件
收集管:用于收集洗脱液样品的容器。自动组分收集器需要特定的收集管。手动收集时,则试管或容器均可使用。
纯度检测方法:一种检测样品里所有蛋白质中目标蛋白相对含量的检测手段。每一步获得的含有目标蛋白的组分都必须在进行下一步纯化工作前进行检测。后面的章节将对一些常用的纯度分析方法进行讨论
柱层析系统
柱层析可以依赖用泵将溶剂以固定流速打入填装好的层析柱的自动设备(图2)来完成或者依靠流动相的重力作用自己完成。自动系统或者重力柱系统均可与自动组分收集器连接使用。两者都有各自的优缺点。GE Healthcare的AKTA FPLC system是目前应用最为广泛的系统之一。

用于蛋白质自动层析分离的Äktaprime plus系统。来自GE
柱层析种类
四种主要的柱层析类型包括亲和层析、离子交换层析 (IEX)、疏水层析(HIC)和体积排阻层析 (SEC)。大部分纯化过程需要用到其中一种或者多种层析方法以获得后续应用所需纯度的蛋白质产物。选择最合适的层析方法并排序就是优化蛋白质纯化工艺最关键的内容。
通过对蛋白质序列进行分析,可以鉴定出其特有的性质以选择相应的纯化过程。在测定蛋白质疏水残基伸展程度的同时,亦可测定其分子尺寸和(某特定pH值时的)电荷情况。
表:蛋白质纯化中最常用的4种柱层析类型
| 层析种类 | 分离蛋白的作用原理 | 结合部分 | 流动相 |
| 亲和 | 特异性作用 | 无竞争配体 | 竞争性配体(特异性);可破坏蛋白质间(非特异性)相互作用力的条件 |
| 离子交换 | 表面电荷 | 低离子强度 | 高离子强度;增加(阳离子交换)或降低(阴离子交换)pH值 |
| 疏水作用 | 疏水性 | 高离子强度 | 低离子强度 |
| 尺寸排阻 | 水力学半径 |
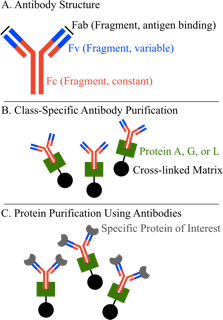
用蛋白A、G、L进行亲和层析的原理示意图
蛋白质洗脱方法
固定相上结合的蛋白质要用可破坏结合作用力的溶剂条件进行洗脱。这些流动相的条件要根据层析类型和目标蛋白质的性质来选择。蛋白质洗脱方法通常包括以下三种:批次洗脱,阶梯式洗脱和线性梯度洗脱。如何选择最好的方法要依靠采用的层析方式和所需的分离效果来决定。
批次洗脱 - 一步即将所有结合蛋白质一次性洗脱。基于特异性相互作用 (如亲层析)的层析方法最好采用这种方式。批次洗脱法没有任何分离效果,但它可以很好地快速去除杂质。它需要事先了解取代目标蛋白所需的缓冲液条件。
阶梯式洗脱 - 连续进行多步批次洗脱,并每次逐渐增强洗脱条件。在阶梯式洗脱中,收集的组分数取决于连续批次洗脱的次数。阶梯式洗脱比批次洗脱的分离效果要好,但比线性梯度洗脱的效果要差。
线性梯度洗脱 - 当流动相以线性梯度洗脱时可收集多种连续流出的组分。对于离子交换层析和疏水作用层析,线性梯度洗脱可以获得最好的分离效果,同时,它还可以收集到大量的连续组分。
由于体积排阻层析中蛋白质和固定相之间不存在相互作用,因此不需要采用任何一种上述洗脱方法。蛋白质上样后,无需改变洗脱缓冲液的条件,即可连续不断地收集各分离组分至所有蛋白质全部被洗脱为止
理想的情况是这根层析柱所采用的洗脱缓冲液同样可用于后续的层析柱,由此可省去两步之间必须的缓冲液置换或者透析操作。
高通量蛋白纯化
在如今的后基因组学时代,对用于结构测定和药物发现/化合物筛选目的的高通量蛋白纯化大有兴趣存在。为了筛选宽范围的构建体并为最佳的最终用途选择一个或多个,研究人员已经利用了一系列可商购获得的自动化/机器人系统,其能够快速,平行,(半)自动化纯化亲和标记蛋白。蛋白质的基本原理仍然适用; 液体处理机器人/自动平台的简单是的流线化和净化过程的加速成为可能。
膜蛋白
细胞产生的约20-30%的蛋白质是整合膜蛋白,并且约50%的小分子药物作用于膜蛋白质。因此,针对解决膜蛋白结构有极大的兴趣。纯化整合膜蛋白的关键步骤是它们从脂质双层的溶解,同时保留其功能完整性。典型的方法包括通过离心分离细胞内膜,随后洗涤剂溶解整合膜蛋白质并高速离心以除去不溶性膜残余物。大量的洗涤剂已被用于膜蛋白溶解,并且在没有文献或实验室先例的情况下,研究者将需要凭经验确定某特定蛋白质的最佳洗涤剂。然后通过本质上与可溶性蛋白相同的柱色谱法纯化溶解的膜蛋白。然而,纯化缓冲液将需包含洗涤剂以保持蛋白质处于可溶状态。膜蛋白的纯化通常非常具有挑战性,因为在从脂质双层初步移除和通过各种纯化步骤后蛋白质功能完整性和聚集的常常丧失。但许多研究小组已经成功地纯化了足够量的膜蛋白用于结构测定(例如结构基因组学联盟 Structural Genomics Consortium)。近来,纳米盘已经成功地用于B家族GPCR的亲和纯化。
下一条:抗体的结构和片段
最新动态
-
04.22
一文读懂EMSA技术核心要点,让“emsa” 秒变“easy”
-
04.02
4·2世界孤独症日 | 聆听“星”声“泌”语,让爱来,让碍走
-
04.01
酵母杂交核心技术:深度Q&A帮你轻松突破实验瓶颈
-
03.19
【客户文献解读,IF>11】食管癌的"隐形推手":MALR-ILF3-HIF1a轴的强大作用
-
03.18
siRNA介绍及药物研发的现状前景
-
03.18
知无不“研”|5篇高分文献带你一览高通量酵母杂交的非凡魅力~
-
02.27
【客户文章分享】SHMT2 通过 5′UTR 依赖性 ADAM10 翻译启动介导小分子诱导的阿尔茨海默病病理学缓解过程
-
01.24
客户文献解读 | 中医为什么能治流感?是玄学还是运气?INT J NANOMED揭示鱼腥草抗病毒机制及范围!
-
01.24
客户文献分享,IF>11|Shank3:脑缺血再灌注损伤的守护者,揭示神经保护的新篇章
-
12.27
文献解读 | 高密度脂蛋白通过miR-181a-5p调控自噬影响血管新生










