免疫印迹实验步骤及问题解决
信息来源:金开瑞 作者:genecreate 发布时间:2019-01-21 16:43:54
一、实验步骤
试剂和缓冲液
1x RIPA 缓冲液: 50 mM Tris, 150 mM NaCl, 0.1% SDS, 0.5% SDS, 1% Triton X-100 或NP40.
1x PBS 缓冲液: 137 mM NaCl, 2.7 mM KCl, 2.7 mM Na2HPO4, 2.7 mM KH2PO4, pH 7.4
BCA或Bradford蛋白分析试剂盒
1.5 M Tris缓冲液 (pH 8.8): 90.68 g Tris-HCl to ddH2O, 500 ml溶液pH调节到8.8
1.0 M Tris缓冲液 (pH 6.8): 60.58 g Tris-HCl to ddH2O, 500 ml溶液pH调节到6.8
10% APS: 100 mg AP 溶于1 ml ddH2O。 用前准备
10% SDS: 10 g SDS溶于100 ml ddH2O。
1x Tris-甘氨酸电泳缓冲液: 25 mM Tris, 230 mM 甘氨酸 (pH 8.3), 0.1% SDS。
3x SDS蛋白加样缓冲液: 150 mM Tris (pH 6.8), 6% SDS, 30% 甘油, 30 mM EDTA和0.2% 溴酚蓝
1x TTBS: 25 mM Tris(pH 7.5): 0.15 M NaCl, 0.05% Tween-20, 0.001% 硫柳汞
1x 转移缓冲液: 3 g Tris, 14.4 g甘氨酸和200 ml甲醇,加ddH2O 到1L
样品准备
细胞培养样品
贴壁细胞
去除培养基,用1X PBS冲洗去掉残留培养基
加入预冷的400 ul-1 ml 1X RIPA缓冲液/100 mm平皿。 在冰上孵育5-10 min。
完全刮下细胞并转移到在冰上预冷的1.5 ml离心管中。
(可选)充分混匀或超声处理。
4°C下12,000 rpm离心10-15 min并收集上清
总蛋白用前需储存在-20°C。
悬浮细胞
(可选)取出100 ul细胞培养也进行细胞计数。
将细胞转移到预冷的1.5 ml或15 ml离心管2000 rpm 4°C离心5 min。
去除培养基并用1 ml预冷的1x PBS重悬细胞,然后转移到1.5 ml离心管中。
2000 rpm 4°C离心5 min。
用1 ml预冷的RIPA 缓冲液/107细胞重悬细胞
细胞悬液在冰上孵育并摇床30 min,或充分混匀或超声处理。
4°C 12000 rpm离心10-15 min收集上清备用。
总蛋白需要在用前储存在-20°C 。
组织
组织准备和定量。将组织切成小块。
加入500-600 ul预冷的1x RIPA缓冲液/100 mg 组织。
将组织充分混匀
4°C 12000 rpm离心15-20min。
收集上清。
总蛋白在用前应储存在-20°C。
蛋白定量
Bradford分析和BCA分析请查看来邦的综述 蛋白定量。
SDS-PAGE
聚丙烯酰胺凝胶
6%-15% 分离胶上注入5%的浓缩胶并插上梳子(10或者15孔)。
| 分离胶浓度(%) | 蛋白大小范围(kDa) |
| 8 | 25-200 |
| 10 | 15-100 |
| 12.5 | 10-70 |
| 15 | 12-45 |
| 20 | 4-40 |
表1: 蛋白分离范围由分离胶浓度决定。
上样和电泳
2X SDS蛋白上样缓冲液与蛋白样品1:1充分混匀。
注胶前先将样品在50-60°C预热。预染Marker可用于监控蛋白分离和转移效率。
在1X Tris-甘氨酸缓冲液在60-120V跑电泳1-3小时
| 分离胶(10ml) | 浓缩胶(3ml) | |||||
| 6% | 8% | 10% | 12% | 15% | 6% | |
| H20 | 5.3 | 4.6 | 4.0 | 3.3 | 2.3 | 2.1 |
| 30% 丙烯酰胺混合物* | 2.0 | 2.7 | 3.3 | 4.0 | 5.0 | 0.5 |
| 1.5M Tris(pH 8.8) | 2.5 | 2.5 | 2.5 | 2.5 | 2.5 | 1.0M Tris (pH 6.8) 0.38 |
| 10% SDS | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.03 |
| 10% APS | 0.1 | 0.1 | 0.1 | .1 | 0.1 | 0.03 |
| TEMED | 0.008 | 0.006 | 0.004 | 0.004 | 0.004 | 0.003 |
表2:分离胶(10ml)和浓缩胶(3ml)的制备方案
蛋白转移
将蛋白转移到PVDF或NC*膜上进行抗体检测
1.将电泳材料,如胶、whatman纸和海绵放入1X转移缓冲液中预先浸润.
2.PVDF膜应在甲醇中预先孵育10秒到1分钟,然后移入转移缓冲液中
3.将材料按如下顺序放置:板(黑色面), 海绵, Whatman纸, 胶, 膜, Whatman纸, 海绵, 板(亮面).
4.将转移装置安置好,黑色面对应黑色电极。
5.转移到冷的1X转移缓冲液中.电转电流和时间应该根据电泳装置的厂家说明推荐设置。
* NC膜不能用甲醇孵育。
将膜放入溶有5%脱脂奶粉的1x TBST中25°C孵育1小时 (或在摇床上4°C孵育过夜)。
抗体孵育
1.按照推荐浓度或根据结果优化浓度,将一抗溶于1X TBST+3% BSA中。
2.在4°C孵育过夜或更长时间,或者在室温下4小时。
3.回收一抗,保存在4°C。然后在室温下在摇床上冲洗膜三次,每次5-10 min。
4.将二抗放入1X TBST中稀释,然后室温下孵育膜1小时,或4°C摇床上2-4小时。
5.在室温摇床上用TBST洗三次,每次10 min
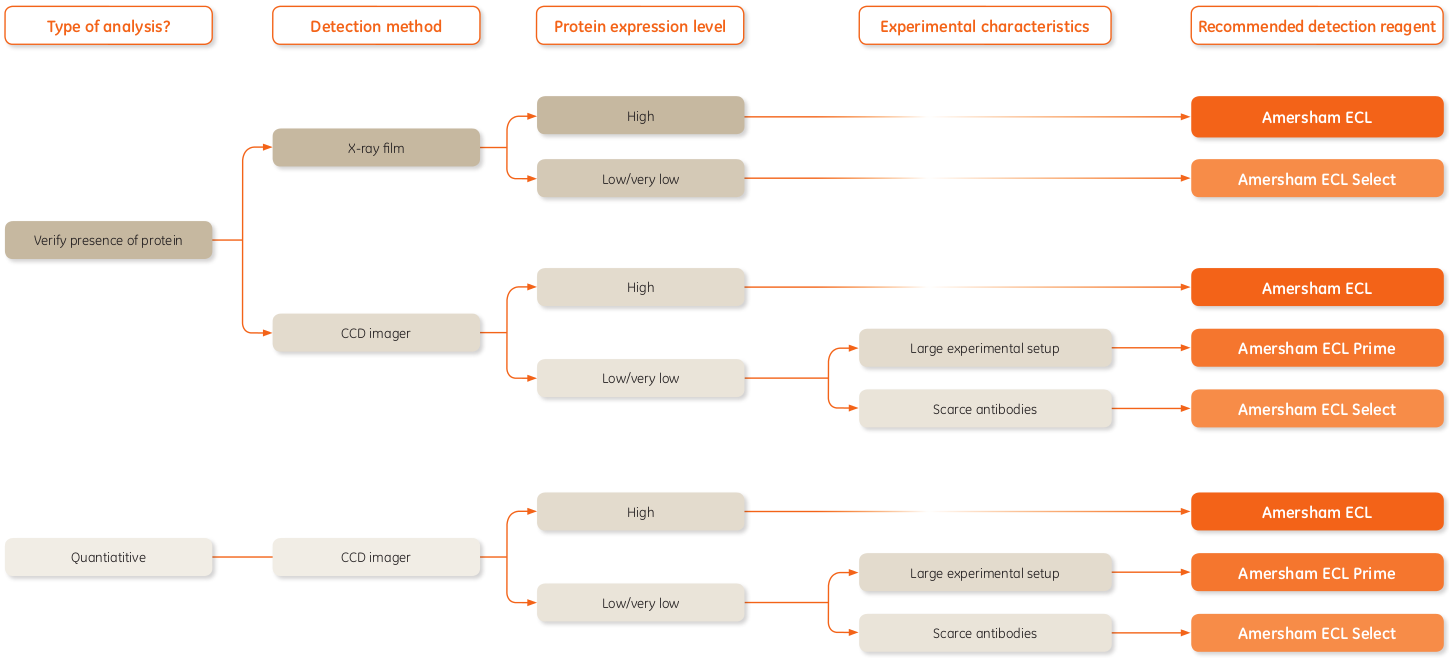
ECL+ 系统和X-ray胶卷被用于HRP标记的二抗。
二、问题解决
没有信号,可能原因
检测的二抗用错了(明确一抗制备的宿主)
一抗或二抗的浓度太低(提高浓度再试一次)
一抗不能识别检测物种的蛋白(检查一抗的特异性)
上样蛋白量太少(增加样品的量)
转移效率太低(改进转移实验步骤。确保PVDF膜用之前用甲醇预孵育)
一抗已经被用很多次了(使用重新稀释的一抗)
封闭时间太长或者洗涤次数太多(减少封闭时间和洗涤次数)
检测试剂盒失效(加入阳性对照并确保试剂盒有效)
叠氮化钠可能抑制二抗(溶解缓冲液中应避免使用叠氮化钠)
一抗或二抗的孵育时间太短(延长孵育时间)
背景太亮
封闭时间太短或者封闭缓冲液有问题(延长封闭时间或者用BSA代替脱脂奶粉)。
一抗或二抗浓度太高。(降低抗体浓度)
洗脱不充分(增加洗脱次数)
孵育温度太高 (确保一抗在4°C孵育)
膜使用错误或者膜已经干了 (避免膜变干)
白色条带或者信号消失很快
一抗或二抗浓度太高(降低抗体浓度)
条带弯曲
电泳电压太高,或者电泳过程中缓冲液温度太高。(降低电压,电泳缓冲液置于冷的环境中)
条带弥散
一抗或二抗浓度太高(降低抗体浓度)
上样蛋白量太大 (降低上样量)
空白区域
转移不均衡(确保膜均衡的贴到胶上,没有气泡)
非特异性信号
一抗或二抗浓度太高(降低抗体浓度)
条带脏或者模糊
平衡时间不够,或者胶与膜的接触不均衡。(确保胶没问题,改进转移步骤)
秃斑
胶与膜之间有气泡(确保胶与膜之间没有气泡)
条带大小与理论不符
一抗特异性差(更换一抗)
一些蛋白可能移动与理论大小差别较大。
不能阐释可能的翻译后修饰
翻译后修饰例如多聚(ADP-核糖基)-PAR链(它能够介导蛋白分子带负电荷)不能通过SDS-PAGE分别。 不过它们能通过CTAB-PAGE分开。 CTAB, 溴化十六烷基三甲基铵 ((C16H33)N(CH3)3Br, cetyltrimethylammonium bromide, hexadecyltrimethylammonium bromide)是一种基于氨阳离子的表面活性剂。
上一条:抗体稀释和抗体滴度解析
下一条:引物合成的步骤及方法介绍
最新动态
-
04.22
一文读懂EMSA技术核心要点,让“emsa” 秒变“easy”
-
04.02
4·2世界孤独症日 | 聆听“星”声“泌”语,让爱来,让碍走
-
04.01
酵母杂交核心技术:深度Q&A帮你轻松突破实验瓶颈
-
03.19
【客户文献解读,IF>11】食管癌的"隐形推手":MALR-ILF3-HIF1a轴的强大作用
-
03.18
siRNA介绍及药物研发的现状前景
-
03.18
知无不“研”|5篇高分文献带你一览高通量酵母杂交的非凡魅力~
-
02.27
【客户文章分享】SHMT2 通过 5′UTR 依赖性 ADAM10 翻译启动介导小分子诱导的阿尔茨海默病病理学缓解过程
-
01.24
客户文献解读 | 中医为什么能治流感?是玄学还是运气?INT J NANOMED揭示鱼腥草抗病毒机制及范围!
-
01.24
客户文献分享,IF>11|Shank3:脑缺血再灌注损伤的守护者,揭示神经保护的新篇章
-
12.27
文献解读 | 高密度脂蛋白通过miR-181a-5p调控自噬影响血管新生










