新研究!三维基因组学揭示精子成熟发育减数分裂过程中染色质的变化!
信息来源:金开瑞 作者:genecreate 发布时间:2019-09-03 14:14:30
题目:Attenuated chromatin compartmentalization in meiosis and its maturation in sperm development
期刊:Nature Structural & Molecular Biology
影响因子:13.333
主要技术:Hi-C、ChIP-seq、RNA-seq
研究背景
生殖发育的标志是减数分裂,即生殖细胞基因组经过重组以促进后代的遗传多样性。在精子发生后期,生殖细胞经历细胞重建和全局染色质重构,最终形成具有功能的精子。在减数分裂开始时,细胞系特异性基因的激活全转录网络过程是在减数分裂后的精子中进行。因此,睾丸具有所有器官中最多样化和最复杂的转录组。然而,生殖细胞染色质是如何促进重要的基因表达程序和为下一代生命设定表观遗传状态,目前尚不清楚。通过对小鼠雄性生殖细胞的特定阶段进行Hi-C分析,发现在减数分裂过程中三维染色质组织分隔减弱。
研究内容及结果
1. 减数分裂前后精子细胞三维染色质结构变化
作者对C57BL/6J小鼠减数分裂前期的粗线精子细胞、第二次减数分裂后的单倍体圆形精子细胞和ESC细胞进行Hi-C实验。结果发现在精子和ESCs中同源染色体的突触和染色体缩合一致,检测到大量的“近”色粒内相互作用。在精子和期间染色体中,染色体内互作概率遵循的幂律为P (s)~s−1,这符合分形球状体模型。相比之下,在粗线期染色体显示出精母细胞染色体逐渐减少互作概率,在基因组的距离3 M遵循的幂律为P (s)~s−0.61,在更大的距离时互作频率急剧下降。在圆形精子之后,成熟精子表现出高度分隔的三维染色质。结果表明,粗线精子细胞减数分裂染色体的大尺度结构类似于有丝分裂染色体,圆形的精子染色质处于成熟精子的中间状态(图1)。
期刊:Nature Structural & Molecular Biology
影响因子:13.333
主要技术:Hi-C、ChIP-seq、RNA-seq
研究背景
生殖发育的标志是减数分裂,即生殖细胞基因组经过重组以促进后代的遗传多样性。在精子发生后期,生殖细胞经历细胞重建和全局染色质重构,最终形成具有功能的精子。在减数分裂开始时,细胞系特异性基因的激活全转录网络过程是在减数分裂后的精子中进行。因此,睾丸具有所有器官中最多样化和最复杂的转录组。然而,生殖细胞染色质是如何促进重要的基因表达程序和为下一代生命设定表观遗传状态,目前尚不清楚。通过对小鼠雄性生殖细胞的特定阶段进行Hi-C分析,发现在减数分裂过程中三维染色质组织分隔减弱。
研究内容及结果
1. 减数分裂前后精子细胞三维染色质结构变化
作者对C57BL/6J小鼠减数分裂前期的粗线精子细胞、第二次减数分裂后的单倍体圆形精子细胞和ESC细胞进行Hi-C实验。结果发现在精子和ESCs中同源染色体的突触和染色体缩合一致,检测到大量的“近”色粒内相互作用。在精子和期间染色体中,染色体内互作概率遵循的幂律为P (s)~s−1,这符合分形球状体模型。相比之下,在粗线期染色体显示出精母细胞染色体逐渐减少互作概率,在基因组的距离3 M遵循的幂律为P (s)~s−0.61,在更大的距离时互作频率急剧下降。在圆形精子之后,成熟精子表现出高度分隔的三维染色质。结果表明,粗线精子细胞减数分裂染色体的大尺度结构类似于有丝分裂染色体,圆形的精子染色质处于成熟精子的中间状态(图1)。
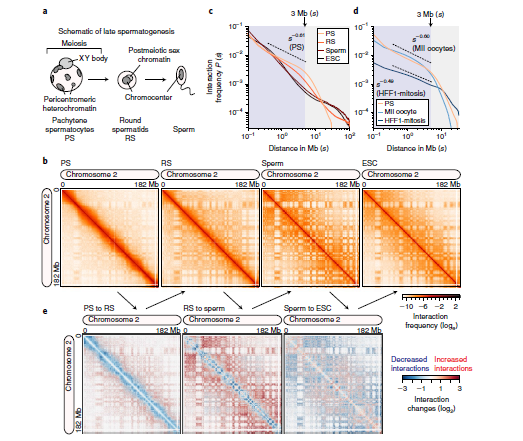
图1 精子形成后期动态三维染色质构象变化
2. 减数分裂过程中染色质三维结构分隔减弱
基因组间隔已被证明与染色质表观遗传状态和基因表达有关。粗线精子细胞和圆形精子细胞均可见基因组间隔,这些间隔相对于精子和ESCs的间隔较弱。圆形精子的基因组间室强度表明,粗线精子细胞与精子处于中间状态,最大特征向量(EV1)捕捉到的基因组间隔与基因表达(RNA-seq)和染色质状态(ChIP-seq)相关。研究表明,在间期发现的基因组分隔,在精子减数分裂过程中减弱,在减数分裂后,生殖细胞分化过程中基因间隔得到保持和加强。
基因组间隔已被证明与染色质表观遗传状态和基因表达有关。粗线精子细胞和圆形精子细胞均可见基因组间隔,这些间隔相对于精子和ESCs的间隔较弱。圆形精子的基因组间室强度表明,粗线精子细胞与精子处于中间状态,最大特征向量(EV1)捕捉到的基因组间隔与基因表达(RNA-seq)和染色质状态(ChIP-seq)相关。研究表明,在间期发现的基因组分隔,在精子减数分裂过程中减弱,在减数分裂后,生殖细胞分化过程中基因间隔得到保持和加强。
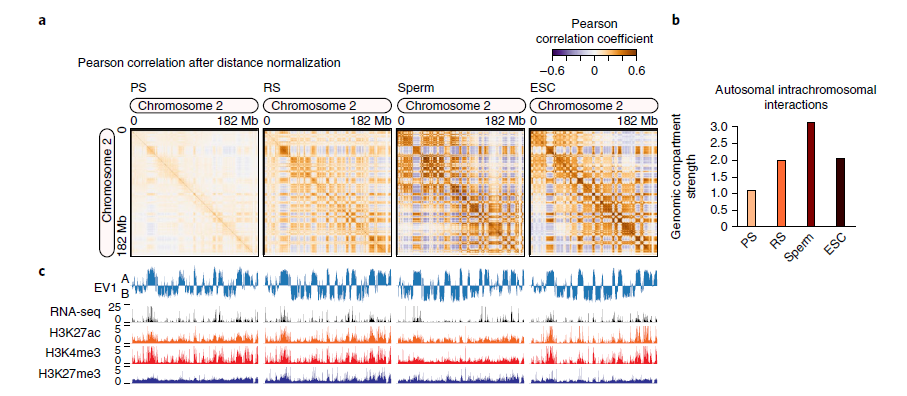
图2 精子发育成熟减数分裂过程中染色质三维结构的分化减弱
3.精子发生后期染色体间相互作用
作者发现在减数分裂过程中,染色体的顶中心端(近着丝粒端粒)之间经常发生染色体间相互作用,非着丝粒端粒(远着丝粒端粒)之间也存在染色体间相互作用。这些特征可能是由于在减数分裂过程中端粒固定在核膜上而引起的。在单个染色体对的基础上,如图3d中的染色体2和4,一般特征也可以观察到,只是程度较轻,基因组间的相互作用也是如此(图3d)。作者观察到最强的染色体间相互作用,就像基因组A室之间的相互作用一样,它们在活跃的组蛋白修饰中富集(图2c),并且在精子形成和ESCs中持续存在(图3d)。与圆形精子中的染色体内相互作用一样,作者观察到圆形精子中的染色体间相互作用比例相对于粗线精子细胞有所增加(图3e)。通过测量基因组间室强度,作者证实粗线精子细胞中也存在染色体间室(图3f)。所观察到的染色体间相互作用反映了精子形成过程中核组织的关键特征,并且无论精子形成的阶段如何,A区都倾向于在不同染色体之间进行互作(图3)。
作者发现在减数分裂过程中,染色体的顶中心端(近着丝粒端粒)之间经常发生染色体间相互作用,非着丝粒端粒(远着丝粒端粒)之间也存在染色体间相互作用。这些特征可能是由于在减数分裂过程中端粒固定在核膜上而引起的。在单个染色体对的基础上,如图3d中的染色体2和4,一般特征也可以观察到,只是程度较轻,基因组间的相互作用也是如此(图3d)。作者观察到最强的染色体间相互作用,就像基因组A室之间的相互作用一样,它们在活跃的组蛋白修饰中富集(图2c),并且在精子形成和ESCs中持续存在(图3d)。与圆形精子中的染色体内相互作用一样,作者观察到圆形精子中的染色体间相互作用比例相对于粗线精子细胞有所增加(图3e)。通过测量基因组间室强度,作者证实粗线精子细胞中也存在染色体间室(图3f)。所观察到的染色体间相互作用反映了精子形成过程中核组织的关键特征,并且无论精子形成的阶段如何,A区都倾向于在不同染色体之间进行互作(图3)。
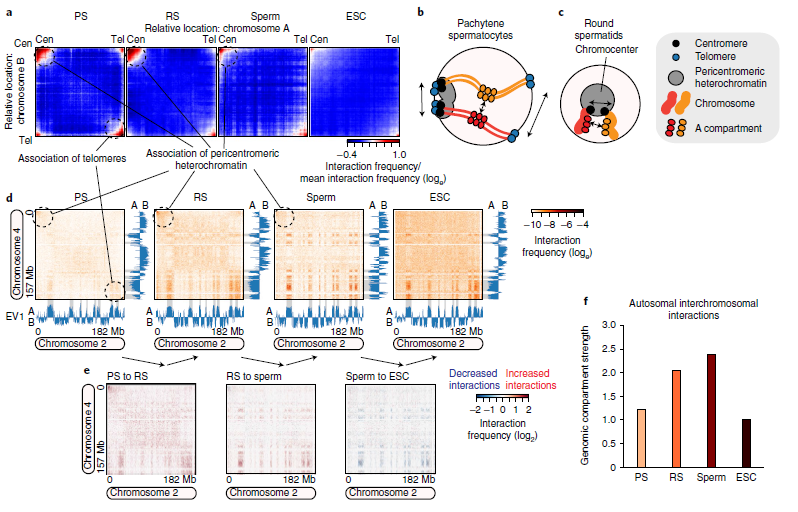
图3 精子发生后期染色体间相互作用
4. 减数分裂中TAD的减弱
在粗线精子细胞和圆形精子细胞中,作者观察到强或弱的TADs,平均长度约1.1 Mb。尽管每个生殖细胞数据集都有许多独特的TAD边界,但粗线精子细胞和精子的边界之间存在子集:粗线精子细胞(2300~27%)、圆形精子(2233~28%)和精子(4541~14%)共有622个TAD边界。综上所述结果表明,在成熟精子中,有许多在减数分裂精子细胞中明显的弱TAD边界得以维持,并形成其他的强边界,三维染色质结构的表观遗传状态是通过减数分裂维持的(图4)。
在粗线精子细胞和圆形精子细胞中,作者观察到强或弱的TADs,平均长度约1.1 Mb。尽管每个生殖细胞数据集都有许多独特的TAD边界,但粗线精子细胞和精子的边界之间存在子集:粗线精子细胞(2300~27%)、圆形精子(2233~28%)和精子(4541~14%)共有622个TAD边界。综上所述结果表明,在成熟精子中,有许多在减数分裂精子细胞中明显的弱TAD边界得以维持,并形成其他的强边界,三维染色质结构的表观遗传状态是通过减数分裂维持的(图4)。
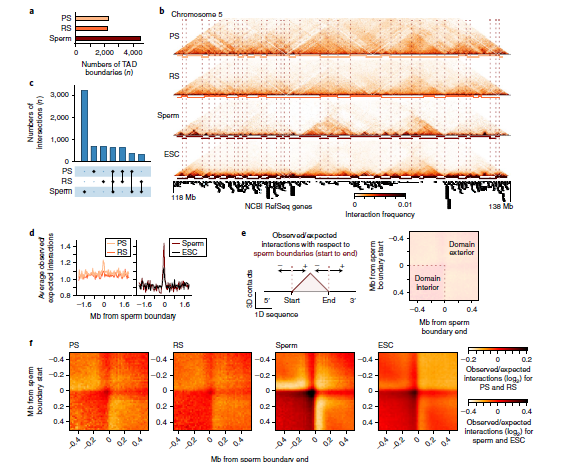
图4精子发育成熟减数分裂中拓扑相关域的减弱
5. 减数分裂过程中的两点相互作用与活跃转录有关
减数分裂间期的高分辨率Hi-C图中,已经定位成对点相互作用,并与转录激活、生成调节元件有关。作者在粗线精子细胞中鉴定出全基因组范围内的1985个点相互作用,并在H3K27ac、H3K4me3的位点上ChIP-seq信号以及RNA-seq信号中均有富集。同样,与基因组的其他区域相比,锚点处组蛋白和RNA-seq数据集的相对丰度更高。通过计算表明,锚点处分别与ChIP-seq和RNA-seq数据集之间存在弱正相关。数据表明,在精子形成的后期,点相互作用是一种高阶的染色质构象,与活跃的组蛋白修饰、基因激活有关。
在粗线期精子细胞和圆形精子细胞的精子TAD边界上观察到H3K27ac、H3K4me3、H3K27me3的强富集,表明在粗线期精子TAD边界存在表观遗传标记。在ESCs中TAD边界上存在组蛋白修饰在精子中的富集,从粗线精子细胞到精子,H3K27me3和H3K4me39富集在同一个隔间中(图5)。
减数分裂间期的高分辨率Hi-C图中,已经定位成对点相互作用,并与转录激活、生成调节元件有关。作者在粗线精子细胞中鉴定出全基因组范围内的1985个点相互作用,并在H3K27ac、H3K4me3的位点上ChIP-seq信号以及RNA-seq信号中均有富集。同样,与基因组的其他区域相比,锚点处组蛋白和RNA-seq数据集的相对丰度更高。通过计算表明,锚点处分别与ChIP-seq和RNA-seq数据集之间存在弱正相关。数据表明,在精子形成的后期,点相互作用是一种高阶的染色质构象,与活跃的组蛋白修饰、基因激活有关。
在粗线期精子细胞和圆形精子细胞的精子TAD边界上观察到H3K27ac、H3K4me3、H3K27me3的强富集,表明在粗线期精子TAD边界存在表观遗传标记。在ESCs中TAD边界上存在组蛋白修饰在精子中的富集,从粗线精子细胞到精子,H3K27me3和H3K4me39富集在同一个隔间中(图5)。
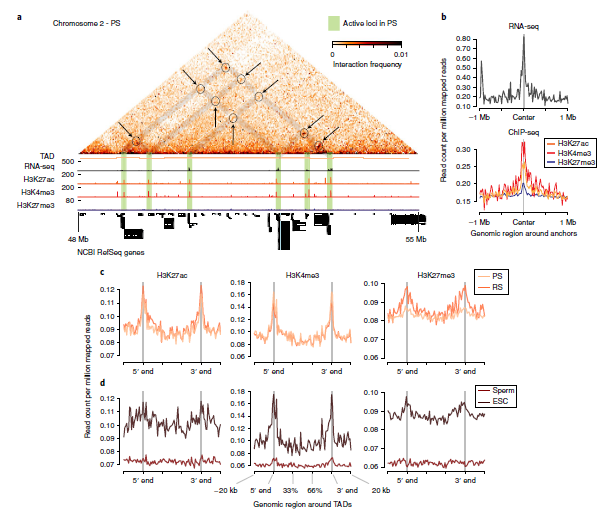
图5 对点相互作用和精子TADs表观遗传标记
6. 卵黄体在减数分裂和减数分裂后的三维染色质结构
粗线精子细胞的相互作用图谱显示,X表现出非完全同源的染色质结构,这与XY体中性染色体的无染色质间隔独特调控相一致。减数分裂过程中失活的X染色体的染色质特征与女性X染色体失活时的染色质特征不同。在女性X染色体失活中,X是通过逐步折叠建立成两个“巨量体”。然而,沉默的雄性X在减数分裂中没有明显的巨量体。作者观察到高阶染色质结构,在圆形精子中以远端相互作用大于10mb的形式出现,与粗线精子细胞一样,减数分裂后的圆形精子缺乏染色质分隔。为了支持这些结果,作者通过测量基因组间室强度,证实在粗线精子细胞和圆形精子细胞的X染色体上染色体内基因组间室并不常见,暗示三维染色质组织在生殖细胞发育过程中性别染色体的独特调控作用(图6)。
粗线精子细胞的相互作用图谱显示,X表现出非完全同源的染色质结构,这与XY体中性染色体的无染色质间隔独特调控相一致。减数分裂过程中失活的X染色体的染色质特征与女性X染色体失活时的染色质特征不同。在女性X染色体失活中,X是通过逐步折叠建立成两个“巨量体”。然而,沉默的雄性X在减数分裂中没有明显的巨量体。作者观察到高阶染色质结构,在圆形精子中以远端相互作用大于10mb的形式出现,与粗线精子细胞一样,减数分裂后的圆形精子缺乏染色质分隔。为了支持这些结果,作者通过测量基因组间室强度,证实在粗线精子细胞和圆形精子细胞的X染色体上染色体内基因组间室并不常见,暗示三维染色质组织在生殖细胞发育过程中性别染色体的独特调控作用(图6)。
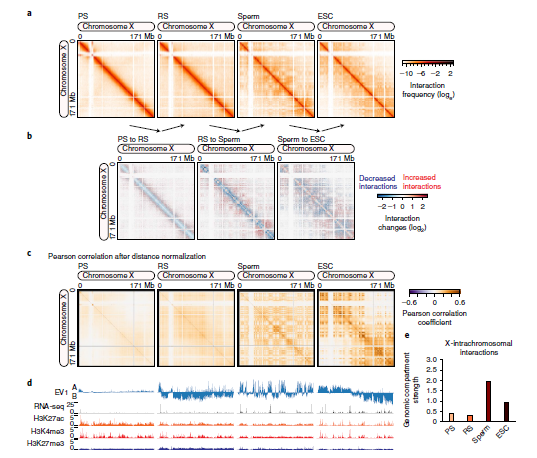
图6 在减数分裂和减数分裂后沉默期间X染色体缺乏高阶结构
文章小结
作者利用Hi-C、ChIP-seq、RNA-seq等技术,发现生殖细胞的染色质的弱区划分与其转录组的独特性和多样性有关,生殖细胞系染色质的成熟到精子中高度分隔的三维染色质结构是下一代生命准备的基础。
解析文献
Kris G. Alavattam, So Maezawa,et al. Attenuated chromatin compartmentalization in meiosis and its maturation in sperm development[J]. Nature Structural & Molecular Biology, 2019, 26, 175–184.
作者利用Hi-C、ChIP-seq、RNA-seq等技术,发现生殖细胞的染色质的弱区划分与其转录组的独特性和多样性有关,生殖细胞系染色质的成熟到精子中高度分隔的三维染色质结构是下一代生命准备的基础。
解析文献
Kris G. Alavattam, So Maezawa,et al. Attenuated chromatin compartmentalization in meiosis and its maturation in sperm development[J]. Nature Structural & Molecular Biology, 2019, 26, 175–184.
最新动态
-
03.19
【客户文献解读,IF>11】食管癌的"隐形推手":MALR-ILF3-HIF1a轴的强大作用
-
03.18
siRNA介绍及药物研发的现状前景
-
03.18
知无不“研”|5篇高分文献带你一览高通量酵母杂交的非凡魅力~
-
02.27
【客户文章分享】SHMT2 通过 5′UTR 依赖性 ADAM10 翻译启动介导小分子诱导的阿尔茨海默病病理学缓解过程
-
01.24
客户文献解读 | 中医为什么能治流感?是玄学还是运气?INT J NANOMED揭示鱼腥草抗病毒机制及范围!
-
01.24
客户文献分享,IF>11|Shank3:脑缺血再灌注损伤的守护者,揭示神经保护的新篇章
-
12.27
文献解读 | 高密度脂蛋白通过miR-181a-5p调控自噬影响血管新生
-
12.27
16分+SCI【客户文章】Nature子刊:鞠怀强/徐瑞华团队揭示FGL1促进转移性结直肠癌免疫逃逸和进展的机制
-
12.13
Science子刊:肠道靶向纳米颗粒可针对产气荚膜梭菌感染提供特异性靶向抗菌肽
-
11.28
医生说:一天一个苹果 ,有没有理论依据?










