又一高分力作!ABHD5在调控结直肠癌化疗反应中的潜在作用!
信息来源:金开瑞 作者:genecreate 发布时间:2019-04-04 11:49:34
题目:ABHD5 blunts the sensitivity of colorectal cancer to fluorouracil via promoting autophagic uracil yield
期刊:Nature Communications
影响因子:12.353
主要技术:病毒包装、蛋白表达
研究背景
结直肠癌(CRC)已成为世界上最常见的癌症之一,自20世纪90年代初以来,氟尿嘧啶(FU)通过抑制胸苷酸合成酶来影响嘧啶合成并耗尽细胞内DTTP池,也通过影响RNA和DNA结合来干扰核苷酸代谢并最终导致细胞死亡。虽然作为单独或联合CRC化疗方案中基础效用药物,但也面临着严峻的耐药性问题。
自噬是一种胞内组分的酶解代谢和循环更新过程,大量实验结果表明,抗化疗的肿瘤细胞在化疗、放疗和靶向药物的挑战下表现出自噬通量的上调,大多停止合成核糖体且消解多余的核糖体,因此操纵自噬过程可能是癌细胞对化疗敏感的一种潜在机制。作者在前期研究基础上,发现一种在CRC中具有肿瘤抑制作用的脂溶因子ABHD5,在人类CRC细胞中表达量显著降低且与恶性特征负相关。重要的是,最新发现ABHD5通过调节自噬在维持染色体稳定性和保护基因组完整性方面发挥着关键作用,促使继续深入探究ABHD5在调控结直肠癌化疗反应中的潜在作用,并提供了ABHD5对基于FU辅助治疗pMMR方案的建设性意见。
研究内容及结果
1. ABHD5降低了CRC细胞对FU的敏感性
作者采用癌症药物敏感性基因组学(GDSC)数据集,将ABHD5表达水平与化疗相关的敏感性数据串联起来。通过皮尔逊相关性分析,ABHD5表达在pMMR 和dMMR CRC细胞系中均与IC50呈现正相关的趋势(图1a)。在细胞功能学检测中,相比较于pMMR-CRC细胞系的SW480细胞(对照组),MTT测定显示ABHD5敲除细胞(ABHD5 KD)在FU处理下IC50值和细胞活力显著降低(图1b-1c),膜联蛋白V/7AAD染色的流式细胞术测定显示ABHD5 KD组在FU处理后细胞凋亡增加(图1d)。在NOD-SCID 鼠的腹腔注射异种移植物(SW480 / ABHD5 KD和PBS / FU)后,ABHD5 KD+FU组肿瘤负荷显著减小,说明ABHD5 KD组对FU的敏感性显著增加(图1e)且肿瘤细胞凋亡率增加(图1f)。与此同时,作者将干预试验调整为肿瘤特异性患者源性异种移植(PDX)模型,选定pMMR源性患者并随机分成四个独立的治疗组:①pMMR/ABHD5 low+PBS、②pMMR/ABHD5 high+PBS、③pMMR/ABHD5 low+FU和 ④pMMR/ABHD5 high+FU,在肿瘤实体图和肿瘤演变图中发现pMMR/ABHD5 low+FU组明显受益(图1g-1h),再通过Caspase-3对凋亡细胞或Ki67对增殖细胞进行免疫染色和分析得到pMMR/ABHD5 low组在FU处理时显著抑制细胞增殖并表现较强的敏感性(图1i-1j)。
期刊:Nature Communications
影响因子:12.353
主要技术:病毒包装、蛋白表达
研究背景
结直肠癌(CRC)已成为世界上最常见的癌症之一,自20世纪90年代初以来,氟尿嘧啶(FU)通过抑制胸苷酸合成酶来影响嘧啶合成并耗尽细胞内DTTP池,也通过影响RNA和DNA结合来干扰核苷酸代谢并最终导致细胞死亡。虽然作为单独或联合CRC化疗方案中基础效用药物,但也面临着严峻的耐药性问题。
自噬是一种胞内组分的酶解代谢和循环更新过程,大量实验结果表明,抗化疗的肿瘤细胞在化疗、放疗和靶向药物的挑战下表现出自噬通量的上调,大多停止合成核糖体且消解多余的核糖体,因此操纵自噬过程可能是癌细胞对化疗敏感的一种潜在机制。作者在前期研究基础上,发现一种在CRC中具有肿瘤抑制作用的脂溶因子ABHD5,在人类CRC细胞中表达量显著降低且与恶性特征负相关。重要的是,最新发现ABHD5通过调节自噬在维持染色体稳定性和保护基因组完整性方面发挥着关键作用,促使继续深入探究ABHD5在调控结直肠癌化疗反应中的潜在作用,并提供了ABHD5对基于FU辅助治疗pMMR方案的建设性意见。
研究内容及结果
1. ABHD5降低了CRC细胞对FU的敏感性
作者采用癌症药物敏感性基因组学(GDSC)数据集,将ABHD5表达水平与化疗相关的敏感性数据串联起来。通过皮尔逊相关性分析,ABHD5表达在pMMR 和dMMR CRC细胞系中均与IC50呈现正相关的趋势(图1a)。在细胞功能学检测中,相比较于pMMR-CRC细胞系的SW480细胞(对照组),MTT测定显示ABHD5敲除细胞(ABHD5 KD)在FU处理下IC50值和细胞活力显著降低(图1b-1c),膜联蛋白V/7AAD染色的流式细胞术测定显示ABHD5 KD组在FU处理后细胞凋亡增加(图1d)。在NOD-SCID 鼠的腹腔注射异种移植物(SW480 / ABHD5 KD和PBS / FU)后,ABHD5 KD+FU组肿瘤负荷显著减小,说明ABHD5 KD组对FU的敏感性显著增加(图1e)且肿瘤细胞凋亡率增加(图1f)。与此同时,作者将干预试验调整为肿瘤特异性患者源性异种移植(PDX)模型,选定pMMR源性患者并随机分成四个独立的治疗组:①pMMR/ABHD5 low+PBS、②pMMR/ABHD5 high+PBS、③pMMR/ABHD5 low+FU和 ④pMMR/ABHD5 high+FU,在肿瘤实体图和肿瘤演变图中发现pMMR/ABHD5 low+FU组明显受益(图1g-1h),再通过Caspase-3对凋亡细胞或Ki67对增殖细胞进行免疫染色和分析得到pMMR/ABHD5 low组在FU处理时显著抑制细胞增殖并表现较强的敏感性(图1i-1j)。
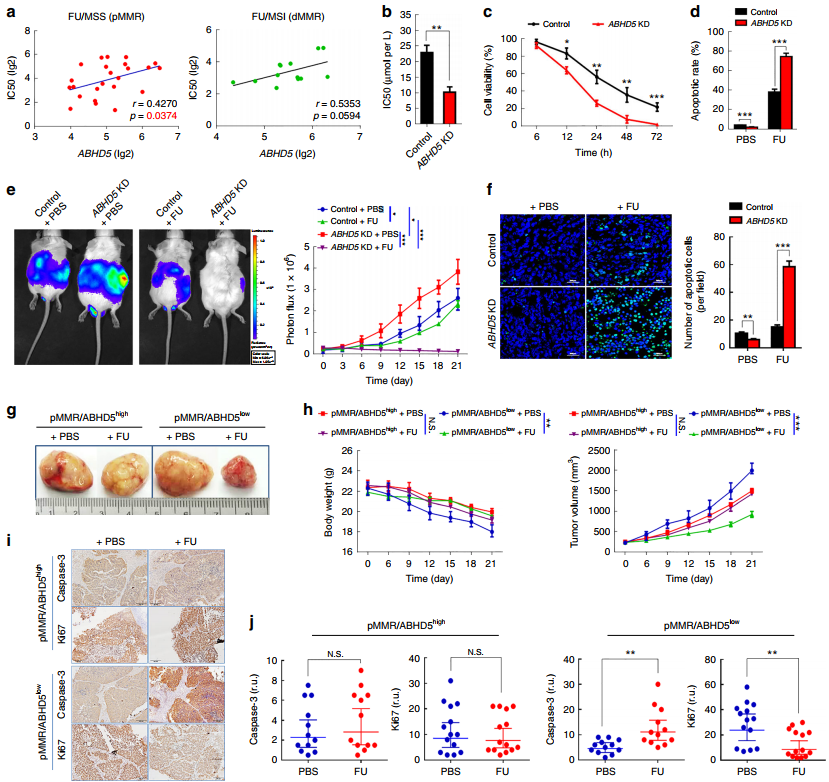
图1 ABHD5阻碍pMMR CRCs对FU的敏感性
2. ABHD5高表达的CRCs并不受益于基于FU的化疗
采用StepMiner算法将NCBI-GEO数据集中361名pMMR-CRCs患者分为ABHD5 high组(262例)和ABHD5 low组(99例),并开展实验来评估ABHD5与预后的关系以及基于FU辅助治疗的益处(图2a-2b),统计数据显示ABHD5 high组更可能是BRAF突变阳性突变型(BRAF MT)、p53野生型(p53 WT)和染色体不稳定阴性型(CIN−),且在单独接受FU手术治疗后pMMR/ABHD5 high组的预后优于pMMR/ABHD5 low组(图2c-2d)。进一步分析人类结肠癌组织微阵列数据,并将432例患者队列分为两组:pMMR/ABHD5 high(256例)和pMMR/ABHD5 low(176例),发现在单独接受FU手术治疗后,pMMR/ABHD5 high组明显倾向于DFS延长的趋势;pMMR/ABHD5 low组明显受益于基于FU的辅助化疗。
采用StepMiner算法将NCBI-GEO数据集中361名pMMR-CRCs患者分为ABHD5 high组(262例)和ABHD5 low组(99例),并开展实验来评估ABHD5与预后的关系以及基于FU辅助治疗的益处(图2a-2b),统计数据显示ABHD5 high组更可能是BRAF突变阳性突变型(BRAF MT)、p53野生型(p53 WT)和染色体不稳定阴性型(CIN−),且在单独接受FU手术治疗后pMMR/ABHD5 high组的预后优于pMMR/ABHD5 low组(图2c-2d)。进一步分析人类结肠癌组织微阵列数据,并将432例患者队列分为两组:pMMR/ABHD5 high(256例)和pMMR/ABHD5 low(176例),发现在单独接受FU手术治疗后,pMMR/ABHD5 high组明显倾向于DFS延长的趋势;pMMR/ABHD5 low组明显受益于基于FU的辅助化疗。
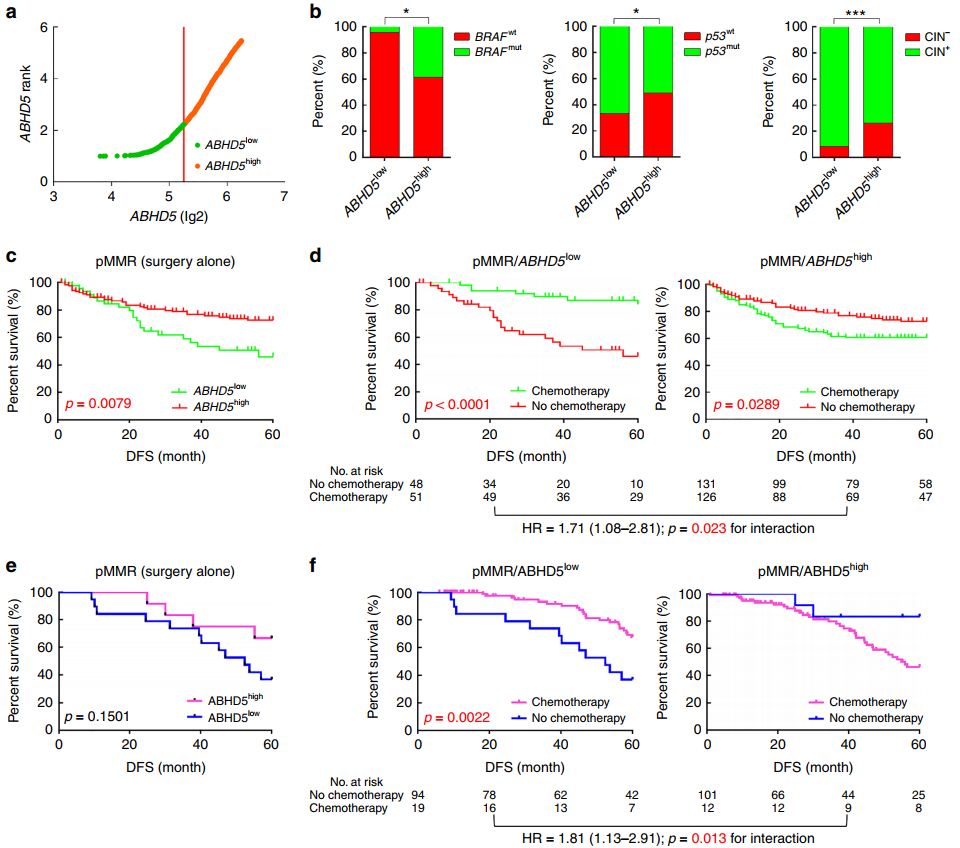
图2 ABHD5的表达以及FU的辅助化疗疗效
3. ABHD5通过提高自噬性尿嘧啶的产量来降低FU的摄取
接下来,作者深入探索ABHD5调节pMMR-CRC细胞对FU的反应机制。通过高效液相色谱测定发现相对于对照组,ABHD5 KD组的胞内FU浓度显著增加(图3a),且在蛋白质印迹分析中发现PBS或FU处理的细胞中均没有发现胸苷酸合成酶(TS)、胸苷磷酸化酶(TP)和二氢嘧啶脱氢酶(DPD)的变化,推测胞内FU浓度与药物吸收能力相关(图3b)。有趣的是,在FU处理后的代谢曲线中,发现ABHD5 KD组的胞内尿嘧啶显著减少(图3c),而不影响嘧啶生物合成的限速酶CPS II和UMPS的变化(图3d),推测ABHD5可能通过一种新的方式影响尿嘧啶的产量。
继续研究GSE38832数据集中122例CRCs,ABHD5 low组溶酶体途径相关成分的平均水平下降(图3e)。基于ABHD5表达的分层聚类分析,推测出溶酶体RNA的降解介导自噬性尿嘧啶的产生(图3f),荧光标记和高含量筛选(HCS)分析显示自噬体通量与胞内FU水平呈负相关(图3g-3h)。值得注意的是,ABHD5 OE组在FU和CQ(氯喹,靶向药物)共同作用下有力地挽救了胞内尿嘧啶和FU的浓度(图3i-3j),相关PDX模型中发现BA(BECN1激活剂)只是适度地逆转ABHD5 KD组中胞内尿嘧啶和FU的浓度(图3k-3l),说明ABHD5通过BECN1以外的机制调节自噬尿嘧啶的产生。
接下来,作者深入探索ABHD5调节pMMR-CRC细胞对FU的反应机制。通过高效液相色谱测定发现相对于对照组,ABHD5 KD组的胞内FU浓度显著增加(图3a),且在蛋白质印迹分析中发现PBS或FU处理的细胞中均没有发现胸苷酸合成酶(TS)、胸苷磷酸化酶(TP)和二氢嘧啶脱氢酶(DPD)的变化,推测胞内FU浓度与药物吸收能力相关(图3b)。有趣的是,在FU处理后的代谢曲线中,发现ABHD5 KD组的胞内尿嘧啶显著减少(图3c),而不影响嘧啶生物合成的限速酶CPS II和UMPS的变化(图3d),推测ABHD5可能通过一种新的方式影响尿嘧啶的产量。
继续研究GSE38832数据集中122例CRCs,ABHD5 low组溶酶体途径相关成分的平均水平下降(图3e)。基于ABHD5表达的分层聚类分析,推测出溶酶体RNA的降解介导自噬性尿嘧啶的产生(图3f),荧光标记和高含量筛选(HCS)分析显示自噬体通量与胞内FU水平呈负相关(图3g-3h)。值得注意的是,ABHD5 OE组在FU和CQ(氯喹,靶向药物)共同作用下有力地挽救了胞内尿嘧啶和FU的浓度(图3i-3j),相关PDX模型中发现BA(BECN1激活剂)只是适度地逆转ABHD5 KD组中胞内尿嘧啶和FU的浓度(图3k-3l),说明ABHD5通过BECN1以外的机制调节自噬尿嘧啶的产生。
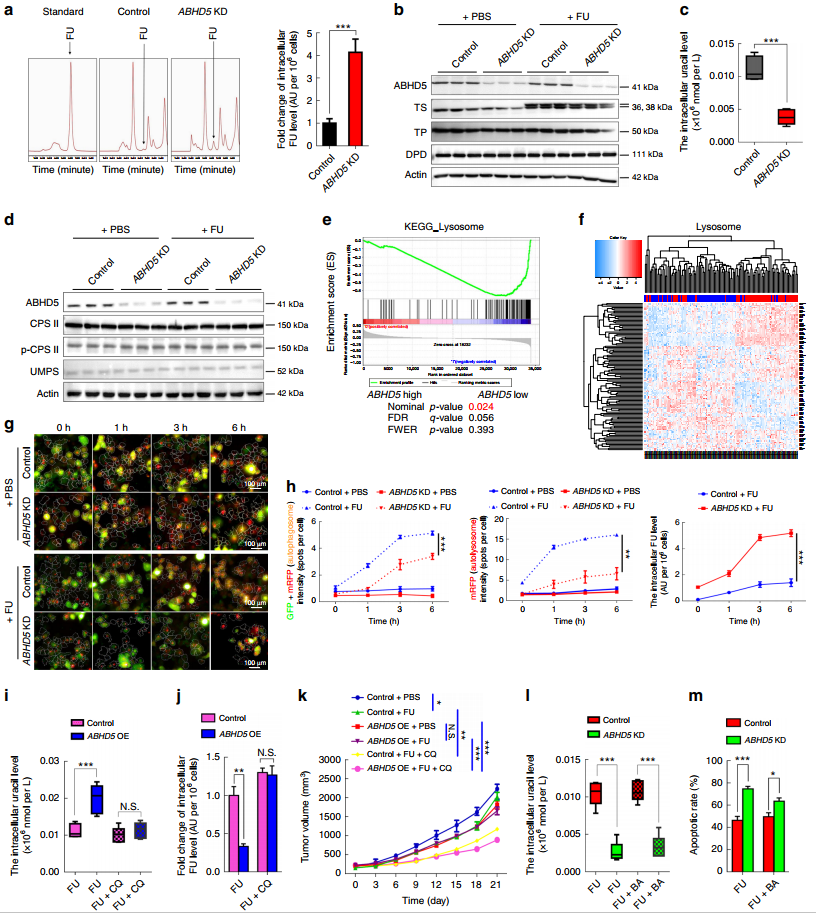
图3 ABHD5影响CRC细胞对FU的摄取
4. ABHD5维持RNASET2活性来促进自噬尿嘧啶的产生
如图4a中尿嘧啶相关核苷酸降解途径所示,采用超高效液相色谱-多反应监测质谱分析在FU作用下尿嘧啶和相关核苷含量的时间依赖性变化,相比于对照组,ABHD5 KD组中胞苷、尿苷和尿嘧啶的含量几乎没有增加(图4b),可简单地阐明RNASET2催化RNA分解过程并参与ABHD5诱导自噬性尿嘧啶的产生(图4c)。值得注意的是,ABHD5 KD组和RNASET2 KD组中胞内的3’CMP、3’UMP、核苷含量均在产生后被消除(图4d),但ABHD5 OE+RNASET2 KD组中显著地逆转了胞内尿嘧啶的产量(图4e)并对FU重新敏感(图4f-4g)。这些证据表明RNASET2在介导ABHD5诱导的自噬性尿嘧啶产生中起着关键作用。
如图4a中尿嘧啶相关核苷酸降解途径所示,采用超高效液相色谱-多反应监测质谱分析在FU作用下尿嘧啶和相关核苷含量的时间依赖性变化,相比于对照组,ABHD5 KD组中胞苷、尿苷和尿嘧啶的含量几乎没有增加(图4b),可简单地阐明RNASET2催化RNA分解过程并参与ABHD5诱导自噬性尿嘧啶的产生(图4c)。值得注意的是,ABHD5 KD组和RNASET2 KD组中胞内的3’CMP、3’UMP、核苷含量均在产生后被消除(图4d),但ABHD5 OE+RNASET2 KD组中显著地逆转了胞内尿嘧啶的产量(图4e)并对FU重新敏感(图4f-4g)。这些证据表明RNASET2在介导ABHD5诱导的自噬性尿嘧啶产生中起着关键作用。
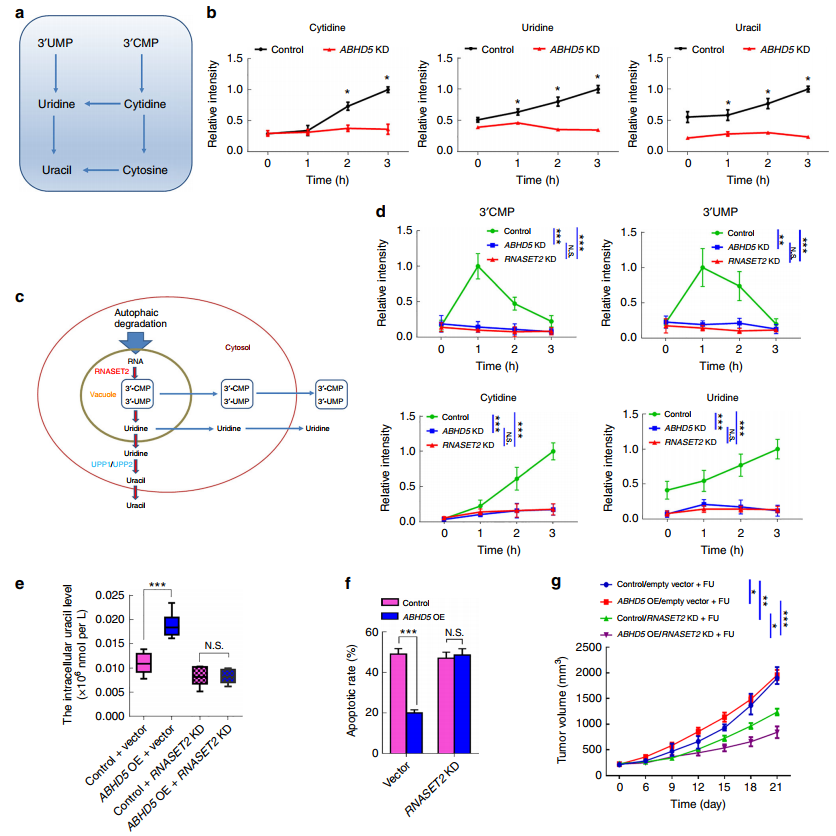
图4 RNASET2介导ABHD5诱导的自噬尿嘧啶产量
5. ABHD5保护RNASET2不被PDIA5灭活
通过免疫荧光染色来发现ABHD5的定位,以及蛋白质印迹法来检测溶酶体溶解物中ABHD5的表达情况,说明ABHD5可能在溶酶体中定位并调节RNASET2 的活性(图5a-5b)。尽管在Co-IP分析结果中ABHD5与RNASET2存在互作关系,但是酵母双杂交试验结果否定了两者的直接互作(图5c-5d),且WB显示在对照组和ABHD5 KD组的溶酶体中RNASET2蛋白表达水平没有变化(图5e),表明ABHD5可能不直接调节RNASET2的活性。
接下来以HuProtTM蛋白芯片为基础,采用人源ABHD5重组蛋白筛选出ABHD5与PDIA5直接互作并通过Co-IP分析证实(图5f-5g)。通过蛋白质-蛋白质对接法预测出PDIA5的β片段是ABHD5和RNASET2互作的共同区域(5h),竞争性结合分析结合体外免疫印迹分析得到ABHD5与RNASET2竞争,直接结合PDIA5并影响其对RNASET2的失活调控(图5i-5j)。基因敲除细胞和PDX的体外验证实验(5k-5m)表明,ABHD5定位于溶酶体,通过与RNASET2竞争来促进自噬性尿嘧啶的产生,从而减弱CRC细胞对FU的固有抵抗力。
通过免疫荧光染色来发现ABHD5的定位,以及蛋白质印迹法来检测溶酶体溶解物中ABHD5的表达情况,说明ABHD5可能在溶酶体中定位并调节RNASET2 的活性(图5a-5b)。尽管在Co-IP分析结果中ABHD5与RNASET2存在互作关系,但是酵母双杂交试验结果否定了两者的直接互作(图5c-5d),且WB显示在对照组和ABHD5 KD组的溶酶体中RNASET2蛋白表达水平没有变化(图5e),表明ABHD5可能不直接调节RNASET2的活性。
接下来以HuProtTM蛋白芯片为基础,采用人源ABHD5重组蛋白筛选出ABHD5与PDIA5直接互作并通过Co-IP分析证实(图5f-5g)。通过蛋白质-蛋白质对接法预测出PDIA5的β片段是ABHD5和RNASET2互作的共同区域(5h),竞争性结合分析结合体外免疫印迹分析得到ABHD5与RNASET2竞争,直接结合PDIA5并影响其对RNASET2的失活调控(图5i-5j)。基因敲除细胞和PDX的体外验证实验(5k-5m)表明,ABHD5定位于溶酶体,通过与RNASET2竞争来促进自噬性尿嘧啶的产生,从而减弱CRC细胞对FU的固有抵抗力。
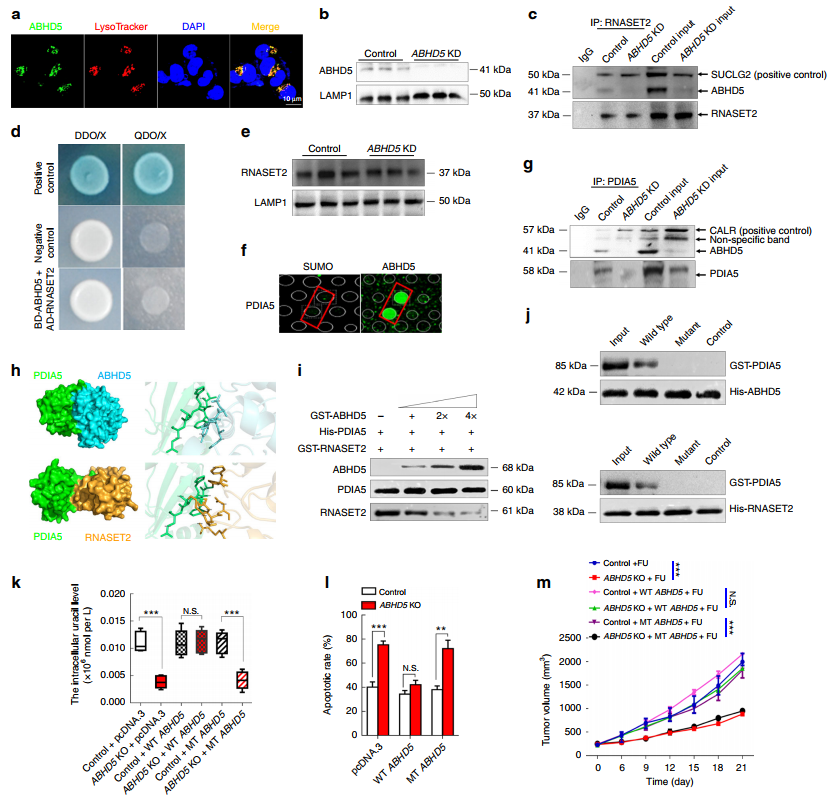
图5 ABHD5维持RNASET2的活性
文章小结
目前临床上FU对CRC的疗效已受到极大的耐药性限制,尽管已知自噬与化疗耐药有关,但尚不清楚选择性自噬降解在调节化疗耐药中的作用机制。在本研究中,作者首次揭示了ABHD5在调节溶酶体功能中的新作用,主要通过调节自噬尿嘧啶的产量使CRC对FU的敏感性起着关键作用,其定位于溶酶体并与PDIA5相互作用,以防止PDIA5与RNASET2相互作用并使RNASET2失活,并通过ABHD5缺陷型实验佐证了相关结论,强调了ABHD5作为基于FU的CRC化疗敏感性预测标志物的深远意义。
解析文献
Ou J, Peng Y, Yang W, et al. ABHD5 blunts the sensitivity of colorectal cancer to fluorouracil via promoting autophagic uracil yield[J]. Nature Communications, 2019, 10(1): 1078-1092.
目前临床上FU对CRC的疗效已受到极大的耐药性限制,尽管已知自噬与化疗耐药有关,但尚不清楚选择性自噬降解在调节化疗耐药中的作用机制。在本研究中,作者首次揭示了ABHD5在调节溶酶体功能中的新作用,主要通过调节自噬尿嘧啶的产量使CRC对FU的敏感性起着关键作用,其定位于溶酶体并与PDIA5相互作用,以防止PDIA5与RNASET2相互作用并使RNASET2失活,并通过ABHD5缺陷型实验佐证了相关结论,强调了ABHD5作为基于FU的CRC化疗敏感性预测标志物的深远意义。
解析文献
Ou J, Peng Y, Yang W, et al. ABHD5 blunts the sensitivity of colorectal cancer to fluorouracil via promoting autophagic uracil yield[J]. Nature Communications, 2019, 10(1): 1078-1092.
最新动态
-
03.19
【客户文献解读,IF>11】食管癌的"隐形推手":MALR-ILF3-HIF1a轴的强大作用
-
03.18
siRNA介绍及药物研发的现状前景
-
03.18
知无不“研”|5篇高分文献带你一览高通量酵母杂交的非凡魅力~
-
02.27
【客户文章分享】SHMT2 通过 5′UTR 依赖性 ADAM10 翻译启动介导小分子诱导的阿尔茨海默病病理学缓解过程
-
01.24
客户文献解读 | 中医为什么能治流感?是玄学还是运气?INT J NANOMED揭示鱼腥草抗病毒机制及范围!
-
01.24
客户文献分享,IF>11|Shank3:脑缺血再灌注损伤的守护者,揭示神经保护的新篇章
-
12.27
文献解读 | 高密度脂蛋白通过miR-181a-5p调控自噬影响血管新生
-
12.27
16分+SCI【客户文章】Nature子刊:鞠怀强/徐瑞华团队揭示FGL1促进转移性结直肠癌免疫逃逸和进展的机制
-
12.13
Science子刊:肠道靶向纳米颗粒可针对产气荚膜梭菌感染提供特异性靶向抗菌肽
-
11.28
医生说:一天一个苹果 ,有没有理论依据?










