蛋白质组学技术在肝损伤生物靶标技术的应用
信息来源:金开瑞 作者:genecreate 发布时间:2018-08-16 16:31:18
文献解读:用蛋白质组学分析单核细胞来源的肝样细胞发现β3整合素作为双氯芬酸诱导的肝损伤的生物靶标
题目:Proteomics Analysis of Monocyte-Derived Hepatocyte-Like Cells Identifies Integrin Beta 3 as a Specific Biomarker for Drug-Induced Liver Injury by Diclofenac
期刊:Frontiers in pharmacology
影响因子:3.831
主要技术:蛋白质组学、流式细胞术
研究背景
药物诱导的肝损伤(iDLL)是导致肝移植失败或死亡的重要原因,是临床的一大挑战。缺少研究iDLL的合适工具影响了研究iDLL的发展。本文作者通过蛋白质组学研究双氯芬酸(Dicol)诱导单核细胞来源的肝样细胞(MH),鉴定到2700多个蛋白,经过筛选发现ITGB3在双氯芬酸诱导后表达量增高。
研究内容及结果
1. MH细胞处理
首先,分离PBMC诱导成MH细胞,随后检测Dicol的药物毒性;其次,选取无毒浓度的Dicol处理MH细胞后,利用蛋白质组学筛选出药物处理后表达差异的蛋白。
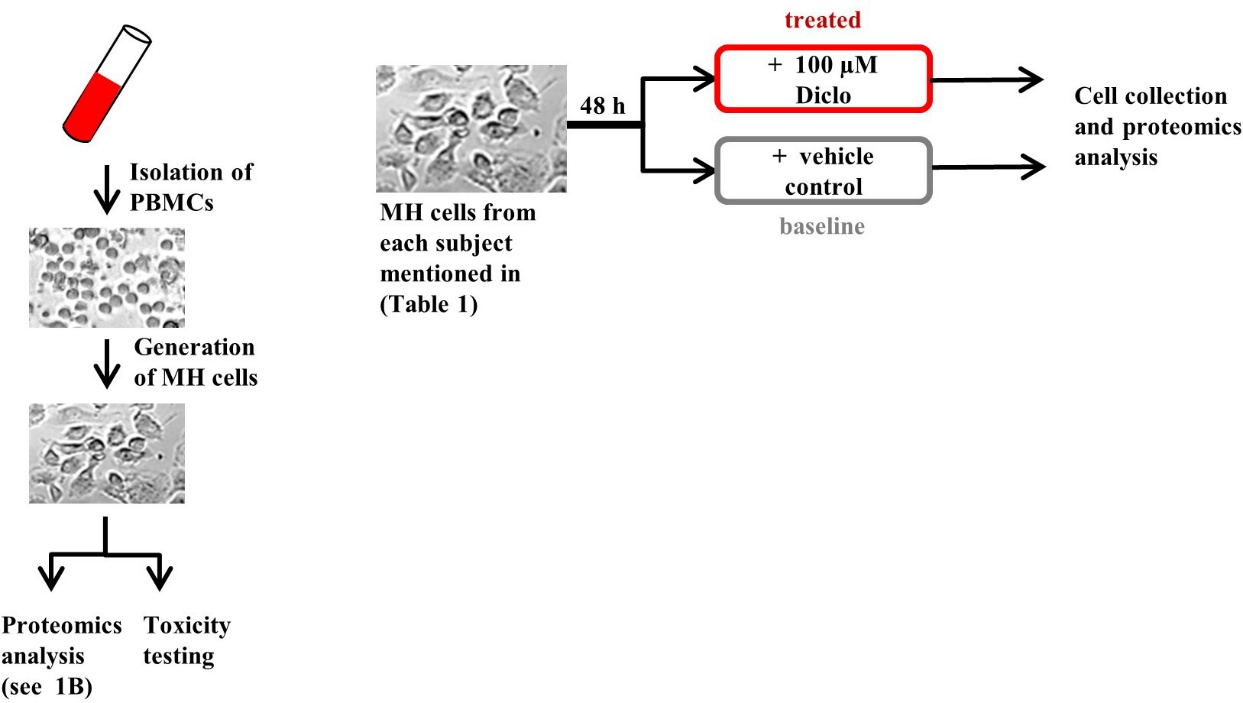
图1 MH细胞蛋白质组学流程
2. 收集临床标本,分不通的组进行比较。
根据不同病人用药情况和比较方式,将病人分为几组:Diclo组(用过Diclo)、control(没用过Diclo)、DicloDILI组(Diclo引起的IDILI)、Diclo-otherDILI组(其它药物导致的IDILI)以及Control_otherDILI(其它药物的对照组)。
表1 不同临床病人的分类比较方式

3. 蛋白质组学筛选差异蛋白
蛋白质组质谱鉴定到总共2700多个蛋白,通过生物信息学分析不同组间蛋白表达差异和不通通路蛋白的占比情况。作者选取DicloDILI病人的MH细胞在Diclo处理后上调的前10个差异蛋白,其中只有1个是膜蛋白即β3整合素(ITGB3),最终从细胞粘附相关通路中选取β3整合素(ITGB3)做后续验证。
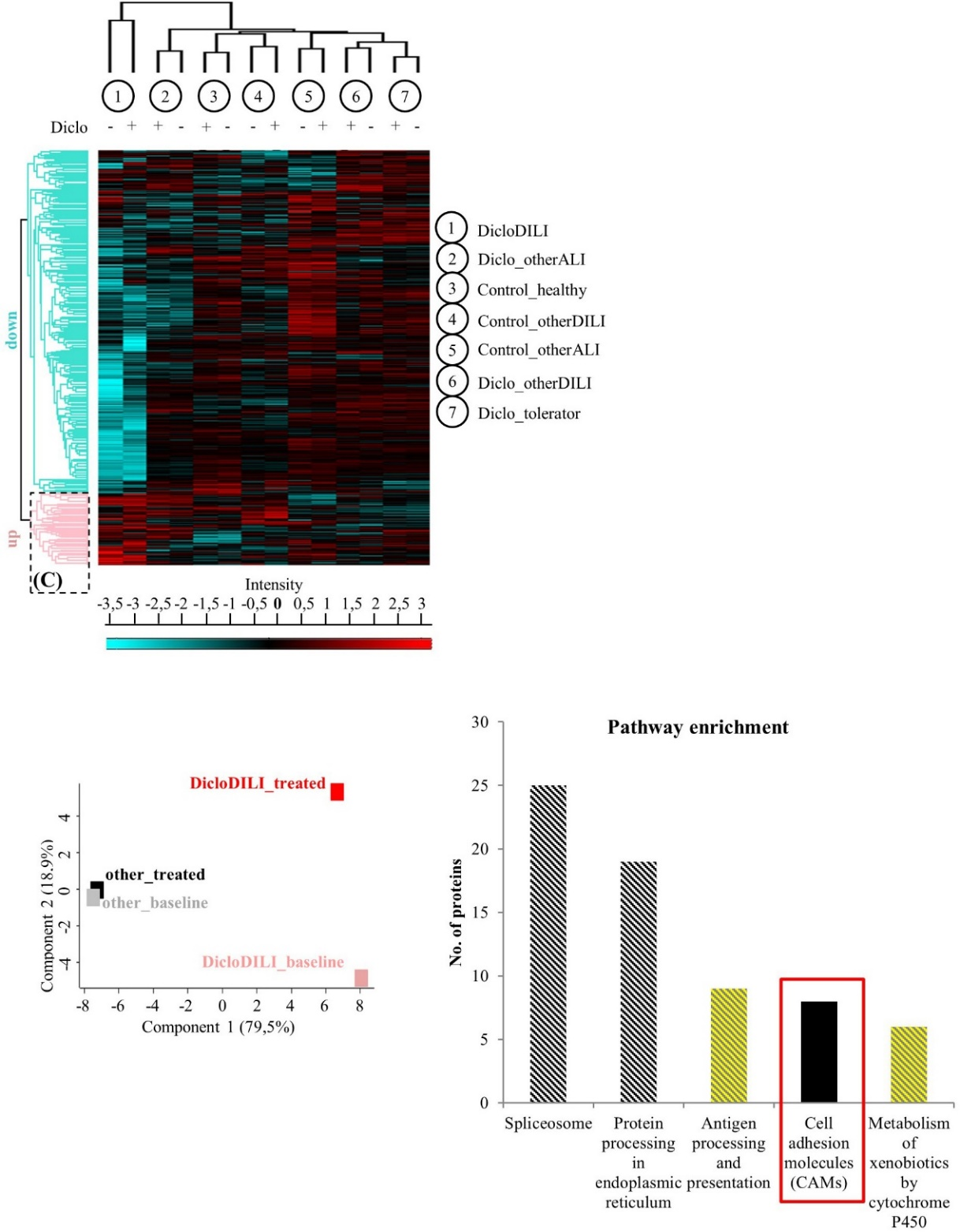
图2 蛋白质组学生物信息学分析
4. 外周血中ITGB3阳性细胞分析.
采集临床标本全血,流式细胞术检测发现DicloDILI病人的全血中ITGB3阳性细胞相对于正常人或其它药物导致的DILI病人低,与MH细胞相反。作者猜想,原因可能是DicloDILI病人在Diclo诱导后外周血中的ITGB3阳性细胞进入到肝脏。为了验证这个猜测,作者用免疫组化检测了肝损伤炎症部位ITGB3细胞,发现DicloDILI病人肝组织中ITGB3阳性细胞更多。

图3 DicloDILI病人外周血中ITGB3阳性细胞分析
5. 肝脏中ITGB3阳性细胞分析
Diclofenac治疗的病人,其外周血中ITGB3阳性细胞转移到肝脏,使肝脏中ITGB3细胞增多。作者通过对肝细胞进行IHC染色验证,用q-PCR检测DicloDILI病人肝脏炎性部位的ITGB3表达情况,发现DicloDILI病人肝脏炎性部位表达量相对较高。
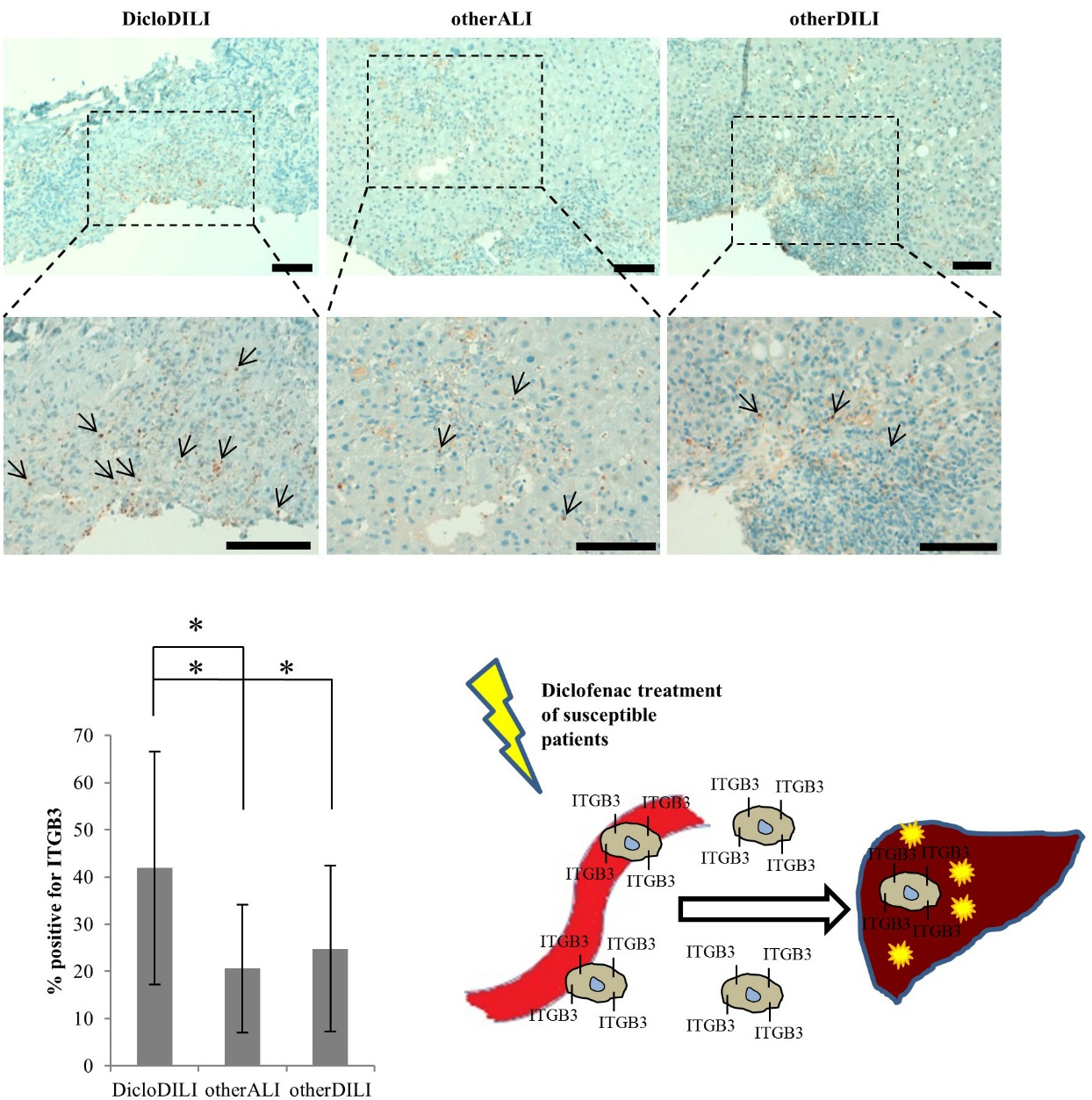
图4 DicloDILI病人肝脏中ITGB3阳性细胞分析
文章小结
药物诱导的肝损伤在肝移植过程中危害比较大,但是却没有很好的生物靶标作为其判断药物损伤的指标。本文作者通过严谨的分组,比较不同药物处理的MH细胞中差异表达蛋白,通过生物信息学分析蛋白的通路和功能,查阅蛋白在细胞中存在的部位,将Diclofenac引起的最有可能作为biomaker的差异蛋白定位到ITGB3,并通过临床标本检测发现Diclofenac引起的肝损伤患者外周血ITGB3阳性细胞量存在差异,猜测其可能是由于Diclofena诱导ITGB3阳性细胞到肝脏所致,并通过免疫组化证明。
解析文献
Diana Dragoi, Andreas Benesic, et al. Proteomics Analysis of Monocyte-Derived Hepatocyte-Like Cells Identifies Integrin Beta 3 as a Specific Biomarker for Drug-Induced Liver Injury by Diclofenac. Frontiers in pharmacology, 2018, doi.org/10.3389/fphar.2018.00699.
参考文献
1. Cox, J., and Mann, M. (2008). MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nat. Biotechnol. 26, 1367–1372. doi: 10.1038/nbt.1511
2. Scheltema, R. A., and Mann, M. (2012). SprayQc: a real-time LC-MS/MS quality monitoring system to maximize uptime using off the shelf components. J. Proteome Res. 11, 3458–3466. doi: 10.1021/pr201219e.
3. Cox, J., Hein, M. Y., et al. (2014). Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Mol. Cell. Proteomics 13, 2513–2526. doi: 10.1074/mcp.M113.031591
4. Robles-Díaz, M., Medina-Caliz, I., et al. (2016). Biomarkers in DILI: one more step forward. Front. Pharmacol. 7:267. doi: 10.3389/fphar.2016.00267
最新动态
-
04.22
一文读懂EMSA技术核心要点,让“emsa” 秒变“easy”
-
04.02
4·2世界孤独症日 | 聆听“星”声“泌”语,让爱来,让碍走
-
04.01
酵母杂交核心技术:深度Q&A帮你轻松突破实验瓶颈
-
03.19
【客户文献解读,IF>11】食管癌的"隐形推手":MALR-ILF3-HIF1a轴的强大作用
-
03.18
siRNA介绍及药物研发的现状前景
-
03.18
知无不“研”|5篇高分文献带你一览高通量酵母杂交的非凡魅力~
-
02.27
【客户文章分享】SHMT2 通过 5′UTR 依赖性 ADAM10 翻译启动介导小分子诱导的阿尔茨海默病病理学缓解过程
-
01.24
客户文献解读 | 中医为什么能治流感?是玄学还是运气?INT J NANOMED揭示鱼腥草抗病毒机制及范围!
-
01.24
客户文献分享,IF>11|Shank3:脑缺血再灌注损伤的守护者,揭示神经保护的新篇章
-
12.27
文献解读 | 高密度脂蛋白通过miR-181a-5p调控自噬影响血管新生










