常见问题
将microRNA装载到外泌体当中,可以考虑孵育,超声,挤压法,冻融法,或者化学转染的方法。这些方法可以使药物很容易进入外泌体的内部。在药物扩散后,外泌体的膜会重新恢复。 孵育法操作相对简单,不会破坏外泌体膜的完整性,适用于装载疏水性小分子。电穿孔主要适用于装载亲水分子,装载效率较高。但是可能破坏外泌体膜的稳定性。如果考虑成本还有装载效率可以选用孵育的方法,除此之外,还有以下方法可以用来装载microRNA. 1、超声方法,在超声过程中,利用超声和匀浆探针使膜变形,从而允许药物扩散到外泌体 2、挤压法,将外泌体和药物混合后通过一个只有100-400nm孔的膜,利用脂质挤压机将药物转入外泌体中。 3、冻融法,将外泌体-药物混合物在−80◦C或在液氮中反复冷冻几个循环,然后再解冻到室温,以确保药物的成功结合。 4、化学转染,外泌体和药物与表面活性剂孵育,导致膜上形成孔,从而渗透药物。最常用的表面活性剂是皂苷,因此这种方法也称为皂苷辅助负载法。
外泌体是内吞起源的细胞外纳米膜状囊泡,体液中循环的外泌体可以通过携带多种功能分子如lncRNA、miRNA、蛋白质等与受体细胞相互作用,介导细胞间通讯,从而影响肿瘤的发生发展。外泌体中检测到的lncRNA称为外泌体源性lncRNA。研究发现外泌体可通过向组织细胞转移肿瘤相关lncRNA,影响肿瘤的生物学进程,在肿瘤增殖、转移、侵袭、肿瘤耐药、肿瘤免疫调节及新生血管形成中发挥重要作用。此外肿瘤来源的外泌体具有转移前微环境的能力,在远处或特定部位转移lncRNA到受体细胞可以产生适合肿瘤细胞生长的转移前微环境。所以肿瘤组织的微环境改变,可能导致肿瘤组织中的的lncRNA含量也会产生变化。
白是膜蛋白,所以不能煮沸吗,其他的marker如HSP70,TSG101都跑出来了,想问一下有这回事吗? 膜蛋白不宜进行煮沸,一般进行煮样后跑出来的条带很杂,不能被抗体很好识别,可能是因为有些抗体识别的是空间结构,而不是一维线性结构。
流式细胞仪检可以测外泌体的标志性蛋白,具体步骤如下: (1)处理样本,提取外泌体; (2)抗体孵育:将提取的外泌体用含2%bsa的pbs溶液溶解,先后进行一抗和二抗孵育,得到cd63标记的外泌体检测液; (3)设置流式细胞仪的参数:正常运行流式细胞仪,进行参数设置; (4)上机检测:将所述cd63标记的外泌体检测液加入pbs溶液重悬,上机检测; (5)利用流式细胞仪分析软件对数据进行分析,得到外泌体的定量检测结果。
对于大多数涉及到Exosome RNA分离的研究,我们推荐使用血浆。血清是血液凝固之后收集的液体,所以其中少了纤维蛋白原,凝血因子,以及多了很多凝血产物。纤维蛋白原可转化为纤维蛋白,具有凝血功能。在因为血清收集后在凝血过程中,血小板受到刺激会产生许多外泌体和其他形式的小泡,因此血清中获得的小泡始终比血浆中多,甚至超过50%的小泡来源于血小板。所以血浆是研究病理生理状态下外泌体更好的介质。因此一般实验选择血浆,但是,在研究与血小板相关的疾病的时候,应优先选择血清。 采血过程中,我们应及时离心除去细胞和血小板,一般在30min内完成,避免长时间存放,同时,需要在室温条件下分离血浆(或者血清),所有样品离心时使用的转速和转子类型要保持一致。
理论上来说提取组织中的RNA,是会把外泌体中的RNA也提出来,但是组织中提取的RNA的量还有种类肯定是多于外泌体的。因为外泌体相对于组织来说只是很小的一部分,包含的物质也不是等同的。
利用NTA可以用于颗粒计数,但是,以颗粒数来定量外泌体,通常都会高估,因为外泌体样本中会存在脂蛋白、蛋白团聚等,这些杂质也会被一起计入。
在电镜拍摄的结果中外泌体的形态应该是那种明显的茶托状或杯状结构,一般,在外泌体边缘处有一圈略微更明亮的亮圈。如果在电镜结果中看到了无膜结构,有可能不是外泌体,有可能是观察到了脂蛋白颗粒或者蛋白质。
最常用的是CD63、CD81等
选用的这些蛋白标志物其实最初是通过纯化细胞外囊泡然后通过质朴分析发现存在于细胞外囊泡的一些高丰度蛋白。 因此也就逐渐开始将他们作为细胞外囊泡标志物。其实CD63、CD9、CD81三个蛋白都是四次跨膜蛋白家族的成员。他们直接参与了细胞外囊泡内容物的分选。TSG101是ESCRT复合体相关的蛋白,ALX直接涉及到了膜泡在形成过程中切割脱离质膜形成独立膜结构的过程。这些标志性蛋白并不是外泌体独有的,只是因为它们主要涉及到了囊泡的形成和分泌过程,多数是膜蛋白或者是ESCRT复合体成员及相关蛋白,他们产生于细胞,定位于细胞内的膜结构附近,因此细胞中也会存在。只是因为细胞外囊泡的形成依赖于这些分子,因此这些分子在囊泡中发挥功能,因此在囊泡丰度要明显比细胞中更高一些。
公众号有外泌体之家,外泌体Mall, 外泌体资讯网址:https://www.exosomemed.com/
在外泌体当中,含有大量疾病相关的多种RNA分子,如miRNA,mRNA,lncRNA等,而外泌体中RNA含量的高低主要是通过荧光定量PCR来鉴定。但是如果出现检测内参不齐,就会限制RNA分子定量检测的标准,而引入外参在外泌体RNA定量分析中是另外一种可选的有效手段。外参法主要是在检测过程中,加入到待检测样本中的外源性物质,加入的外源性物质可以很精确的反映不同样本在检测过程中出现的偏差。所以若是出现内参不齐时,可以考虑引入外参。
ELISA可以用来检测样本中特定蛋白或细胞因子含量,同样也是可以用来检测外泌体中一些标志性蛋白。ELISA试剂盒检测的样本是有多种类型的,如血清、血浆、尿液、细胞培养上清或组织匀浆液等,对于不同的样本,前期的处理方式也是不同的, 对于ELISA实验的来说,实验样本的处理非常关键。在处理过程中,使提取溶剂与容器内的样品充分接触以深入到样本组织内部,提取待测成分。在净化过程中加入的溶剂,可能会降低待测组分的浓度或者不适宜直接分析,需要去除全部有机溶剂。同时要对尽量去除待测样本中的杂质,以防干扰实验结果。
正常情况下,血清中外泌体的含量还是很高的。一般常规实验血清纯化外泌体,建议可以先对外泌体进行鉴定,通过电镜检测观察一下外泌体的是否具有杯状结构,然后通过NTA检测一下粒径大小和粒径浓度,确定没问题进行再进行WB验证。 WB实验失败的一些原因:(1)抗体染色不充分,可以增加抗体浓度,延长孵育时间进行改善。(2)检查酶是否失活,可以直接将酶和底物进行混合,如果不显色则说明酶失活了。选择在有效期内、有活性的酶联物。(3)可以增加阳性对照,如果阳性对照有结果,但标本没有,则可能是标本中不含靶蛋白或靶蛋白含量太低。可以增加标本上样量解决靶蛋白含量低的原因。(4)检查抗体是否失效,看抗体是否过期,工作液尽量现配现用。
目前外泌体蛋白提取的方法相对较少,有的可以通过购买试剂盒来购买提取外泌体蛋白。在一篇专利中提到如何提取血清中的外泌体,专利申请号:CN201810287204.6 专利名称:提取外泌体及外泌体蛋白的方法 提取外泌体方法步骤:所得含有外泌体的材料(即洗涤后的沉淀)置于冰上,向其中加入18μL4g/100mL的SDS水溶液,然后超声(超声条件在100W下进行)裂解20分钟,得到超声产物;将超声产物在16000g下离心5分钟,收集全部上清液;向上清液中加入82μL 8M尿素水溶液和二硫苏糖醇,得到裂解液,该裂解液中二硫苏糖醇的浓度为20mmol/L;将该裂解液在37℃孵育4小时,得到裂解产物;将裂解产物转移至FASP管中,用8M尿素水溶液洗涤(FASP管是一种按分子量截留的管,洗涤过程都是通过离心完成,离心条件为14000g离心10分钟,离心以后,绝大部分溶液和小分子物质被离心至下层接收管子里,外泌体被截留在上层的FASP管中)2次;然后加入碘乙酰胺(终浓度50mmol/L),室温下避光反应1小时,用50mM碳酸氢铵水溶液洗涤3次,加入1μg胰蛋白酶,37℃酶切12小时,将所得溶液45℃热干,用0.1%(v/v)甲酸水溶液定容,得到外泌体蛋白提取液,将外泌体蛋白提取液上样进行LC-MS/MS分析,上样量为1μg。所得含有外泌体的材料(即洗涤后的沉淀)置于冰上,向其中加入18μL4g/100mL的SDS水溶液,然后超声(超声条件在100W下进行)裂解20分钟,得到超声产物;将超声产物在16000g下离心5分钟,收集全部上清液;向上清液中加入82μL 8M尿素水溶液和二硫苏糖醇,得到裂解液,该裂解液中二硫苏糖醇的浓度为20mmol/L;将该裂解液在37℃孵育4小时,得到裂解产物;将裂解产物转移至FASP管中,用8M尿素水溶液洗涤(FASP管是一种按分子量截留的管,洗涤过程都是通过离心完成,离心条件为14000g离心10分钟,离心以后,绝大部分溶液和小分子物质被离心至下层接收管子里,外泌体被截留在上层的FASP管中)2次;然后加入碘乙酰胺(终浓度50mmol/L),室温下避光反应1小时,用50mM碳酸氢铵水溶液洗涤3次,加入1μg胰蛋白酶,37℃酶切12小时,将所得溶液45℃热干,用0.1%(v/v)甲酸水溶液定容,得到外泌体蛋白提取液,将外泌体蛋白提取液上样进行LC-MS/MS分析,上样量为1μg。
超速离心法是最常用的外泌体纯化手段,采用低速离心、高速离心交替进行,可分离到大小相近的囊泡颗粒。本实验室通过超速离心法提取植物外泌体,有的外泌体粒径大小在200nm左右,提取的浓度在正常范围内。一般在样本前处理步骤最后一步经0.22微米滤膜过滤,除去较大的囊泡,再进行超离即可。或者可以选用试剂盒或者尺寸排阻方法提取外泌体。
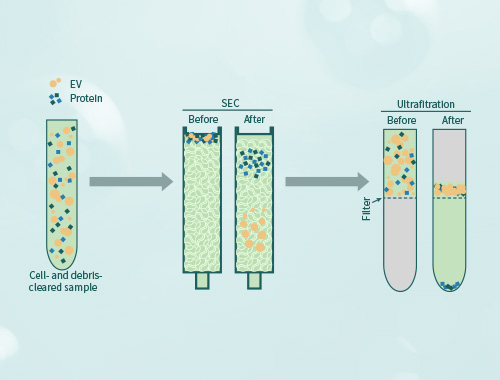
1. 超速离心法是最常用的外泌体纯化手段,也是普遍认可的一种方式,采用低速离心、高速离心交替进行,可分离到大小相近的囊泡颗粒。 优点:无需特殊试剂,操作简便,适合大批量样本。 缺点:耗时耗力,纯度相对较低,回收率不稳定,重复离心会一定程度损伤外泌体,设备要求高。 2. 抗体亲和(磁珠)法利用包被单克隆抗体的磁珠结合外泌体,外泌体表面有其特异性标记物(如CD63、CD9蛋白),用包被抗标记物抗体的磁珠与外泌体囊泡孵育后结合,即可将外泌体吸附并分离出来。 优点:纯度较高,特异性和重复性好、操作简便、无设备限制。 缺点:效率和回收率较低,仅能捕获表达特定抗原的目标外泌体,外泌体生物活性易受pH和盐浓度影响,囊泡完整性影响较大。 3. 微流控指的是使用微管道(尺寸为数微米到数百微米)处理或操纵微小流体(体积为纳升到阿升)的系统所涉及的科学和技术。这种方法具有分离生物颗粒速度快,纯度高,节省样本,集成度高等优点。因此,虽然微流控技术在外泌体分离方面的应用仍处于起步阶段,却已经成为了当前研究的热点。目前,近些年,基于微流控的外泌体分离技术也在不断出现。 4. 尺寸排阻色谱(SEC)是基于尺寸而非分子量分离大分子,尺寸排阻色谱可以精确地分离大分子和小分子。SEC主要用于分离血液和尿液中的外泌体,不过,这种外泌体提取方法需要很长时间,并且不适合处理大量样品。
外泌体鉴定可以通过电镜、粒径以及WB来进行,生物标志物可以选择CD63、CD9、CD81 以及TSG101、HSP70、ALIX,一般通过WB的方式验证外泌体是否含有一些标志性蛋白。
推荐使用华美公司的外泌体提取试剂盒来提取尿液中的外泌体,它能快速提取高质量高纯度的外泌体。目前主流的提取外泌体的方法都各有利弊:使用尺寸排阻色谱(SEC)是基于尺寸而非分子量分离大分子,尺寸排阻色谱可以精确地分离大分子和小分子。SEC主要用于分离血液和尿液中的外泌体,不过,这种外泌体提取方法需要很长时间,并且不适合处理大量样品。使用超速离心可以一次性获得较多外泌体,但是纯度不足;密度梯度离心法分离到的外泌体纯度高,但是前期准备工作繁杂、耗时、量少; 抗体亲和(磁珠)法:纯度较高,特异性和重复性好、操作简便、无设备限制。缺点:效率和回收率较低,仅能捕获表达特定抗原的目标外泌体,外泌体生物活性易受pH和盐浓度影响,囊泡完整性影响较大。
细胞培养液的量建议选择在合适的范围,但是目前尚未发现,培养液的量过多会影响外泌体的浓度。