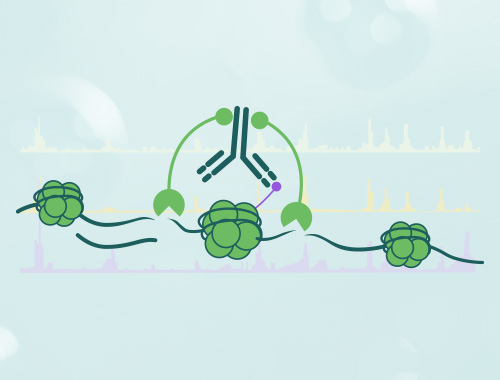
CUT&TAG
- 耗时短
- 信噪比高
- 高空间分辨率
- 高灵敏度
- 低样本需求
服务特色
结合了ChIP-seq的优点和基于Tn5转座酶的tagmentation⽅法,能够快速、⾼效地鉴定染⾊质上蛋⽩质的结合位点。相较于传统的ChIP-seq技术,Cut&Tag具有更快的实验速度、更⾼的分辨率和更低的细胞输⼊要求。
服务介绍
CUT&Tag(CleavageUnderTargetsandTagmentation),即靶向剪切及转座酶技术,是⼀种利⽤酶锚定技术进行高效、⾼分辨率的DNA测序⽂库构建方法,也是替换传统的ChIP-Seq⽤以研究蛋白质-基因组互作关系研究的新⽅法,属于新⼀代超微量ChIPSeq技术。可用于检测组蛋白、RNApolymeraseII和转录因⼦等具有DNA结合功能的蛋白种类,对表观遗传学、肿瘤和干细胞等领域的研究具有重要意义。
CUT&Tag(Cleavage Under Target & Tagmentation)技术是一种研究蛋白质-DNA互作的新方法,它与ChIP-seq研究目的相同,在建库细胞量、信噪比、样本重复性等都有优势。
CUT&Tag 方法中用到了预装接头 DNA 并与蛋白 A/G 融合的超高活性 Tn5 转座酶。这种融合蛋白能与一抗结合,在抗体附近切割 DNA,并插入带有接头序列的短标签。回收标签化的 DNA 片段后,使用引物识别添加的标签中的序列进行 PCR 扩增,以生成测序文库。
原理简介:
在抗体引导下,ChiTag酶仅在目的组蛋白修饰标志、转录因子、染色质调控蛋白结合染色质的局部进行目的 DNA的⽚段化的同时添加测序接头,并释放到细胞外,而绝⼤部分无关的染色质还留在细胞核内,因而整个实验的信噪比大幅提⾼,同时简化了实验步骤。该方法可⼀管式⾼通量应⽤,并可与单细胞测序平台「⽆缝」结合。ChiTag酶在打断基因组的同时加上接头,不需要繁琐的补平加 A加接头,在⼀天内可以完成从细胞到测序⽂库制备全流程。
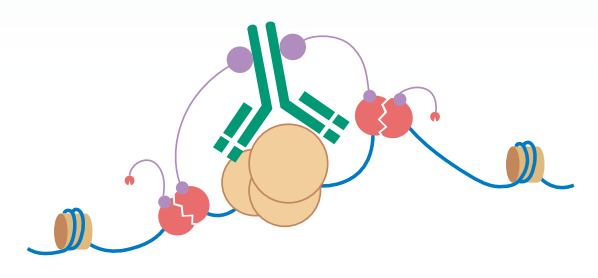
服务优势
- 低样本需求:细胞起始量较低(单细胞 5*10^5 ),从百万级降低到单细胞⽔平;
- 高重复性:CUT&Tag方法具有较高的重复性,可在相同样本中得到一致的结果;
- 高信噪比:相比传统的染色质免疫沉淀(ChIP)方法,CUT&Tag方法信噪比较高,减少非特异性结合和背景噪音;
- 流程简便:无需甲醛交联、细胞破碎和超声片段化DNA等步骤,简化实验操作流程;
- 简化的文库构建:通过添加“接头”到转座子上,只需进行简单的PCR扩增即可获得高质量的NGS文库;
- 较低的测序深度:相较于ChIP方法,CUT&Tag方法在保持高质量结果的同时,测序深度减少10倍左右,节省测序成本。
服务流程
客户提供
1、细胞量:离心后肉眼可见明显细胞量(约10^6)即可进行CUT&TAG,足量细胞加冻存液后用冻存管装,干冰寄送,若要做WB 验证,细胞量需多一倍。
2、抗体需为ChIP级别抗体:抗体≥30ul抗体/次(分装管需要提供抗体说明书或品牌货号)
3、我司提供ChIP级标签抗体种类及价格请私聊确认
最终交付
- 结题报告以及全部原始数据。
- 测序数据质量评估:过滤掉低质量数据,保证数据质量
- 与参考基因组比对:reads分布及比对结果可视化
- peak峰calling:分析蛋白结合位点
- motif分析:蛋白结合序列的偏好性
- peak峰相关基因注释:寻找蛋白潜在调控基因
- 差异peak分析:分析不同样本间差异peak峰
- 相关基因功能分析:相关基因GO, KEGG富集分析
服务说明
案例分析
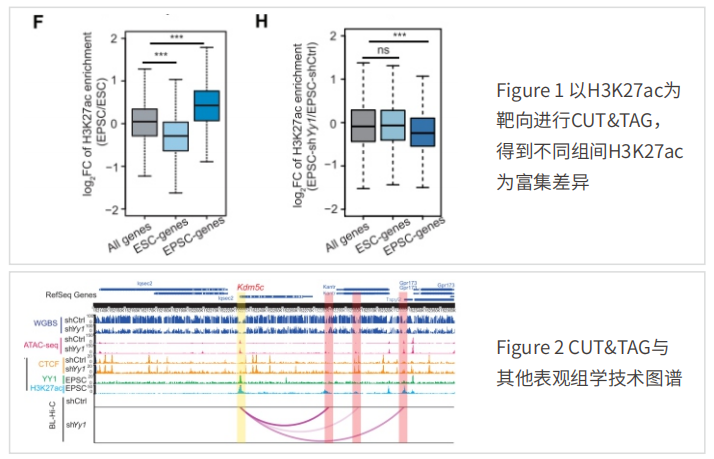
1、Yy1保护与扩展多能性相关的多维表观遗传景观
具有形成胚胎和胚胎外谱系的潜⼒的胚胎⼲细胞(ESCs)称为扩展多能⼲细胞(EPSCs)。2022年研究⼈员运⽤CUT&TAG、ATAC-seq、Hi-C等技术探究EPSC多维度表观调控机制。结果表明,转录因⼦Yy1与EPSC中特定的开放染⾊质区域结合。Yy1缺失导致DNA低甲基化,并通过促进CCCTC结合因⼦(CTCF)介导的围绕其基因座的EP相互作⽤的形成,上调Kdm5c和Hdac6的表达,从⽽显著降低H3K4me3和H3K27ac在EPSC特异性基因启动⼦上的富集。
⽂献:
Xiaotao Dong and others, YY1 safeguard multidimensional epigenetic landscape associated with extended pluripotency, Nucleic Acids Research, Volume 50, Issue 21, 28 November 2022, Pages 12019–12038, https://doi.org/10.1093/nar/gkac230
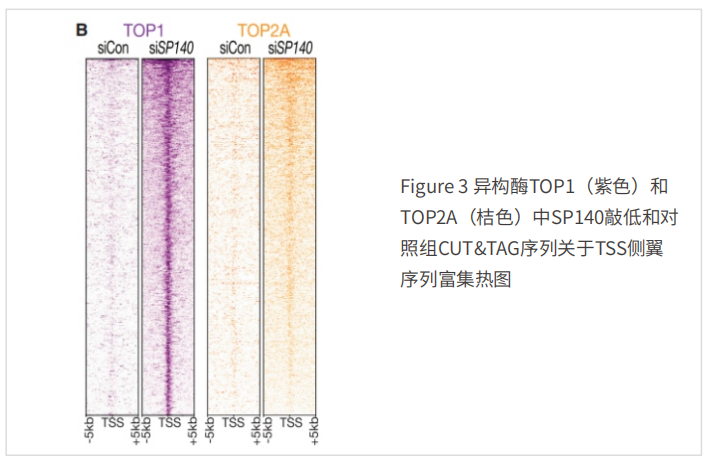
2、表观遗传阅读器SP140功能丧失导致克罗恩病
斑点蛋⽩140(SP140)是⼀种免疫受限的植物同源结构域和含有溴化域的表观遗传“阅读器”,SP140功能缺失突变与克罗恩病相关。在2022年⼀项研究中,证明了SP140的存在会抑制健康细胞中的拓扑异构酶活性从⽽减少TOP与染⾊质的结合。⽽SP140的缺失导致TOP活性释放,最终导致了巨噬细胞基因表达和对细菌的杀伤作⽤缺陷,从⽽造成了肠道的异常。⽂
章还强调了突变位点可能是潜在治疗靶点。
⽂献:
Amatullah H, Fraschilla I, Digumarthi S, et al. Epigenetic reader SP140 loss of
function drives Crohn's disease due to uncontrolled macrophage topoisomerases.Cell.2022;185(17):3232-3247.e18.doi:10.1016/j.cell.2022.06.048
常见问题与解析 (Q&A)
适用于常规哺乳动物细胞的蛋白质-DNA互作研究,酵母、植物等细胞可以经过特殊的处理(破除细胞壁或者提取细胞核)来进行实验。分析的时候应该保证该物种有参考基因组,且注释完整,如果需要联合分析,应保证组学基因组和样本命名一致。而细菌样本不适合做CUT&Tag,因为有一层细胞壁,不能直接与Con A beads结合,且细菌没有完整的核结构,因此无法开展此项实验。
CUT&Tag能在异染色质区域检测到组蛋白修饰和结合蛋白,常用于研究异染色质相关的组蛋白修饰,如H3K27me3和H3K9me3。除此之外,它对低丰度转录因子的检测效果优于ChIP-seq,所需细胞量更少,即使这些因子在基因组中的结合位点较少也能精确识别转录因子的结合位点。
相关技术服务
| ▶ 酵母单杂交 | ▶ EMSA | ▶ DNA pull-down |
| ▶ GST pull-down | ▶ CO-IP | ▶ ChIP-qPCR |
| ▶ RNA pull-down | ▶ RIP-qPCR | ▶ 酵母双杂交 |
| ▶ 双荧光素酶报告系统 | ||
相关资源
1、CUT&Tag与ChIP-Seq区别比较
|
CUT&Tag |
ChlP-Seq |
|
1、细胞渗透性处理 |
1、甲醛交联处理细胞 |
|
2、一抗进入细胞,与目的蛋白结合,二抗进入细胞,与一抗结合 |
2、细胞破碎,收集裂解液 |
| 3、pA-Tn5转座体进入细胞,与抗体结合 | 3、超声打断基因组DNA |
|
4、加入Mg2+激活转座体,片段化目的蛋白局部DNA |
4、加入一抗和Protein A磁珠,进行免疫沉淀 |
|
5、提取DNA, PCR,文库构建完成 |
5、洗脱,解交联 |
| 6、高通量测序 | 6、DNA补平,加A,加接头 |
| 7、PCR,文库构建完成 | |
|
8、高通量测序 |
|
参数 |
ChIP-Seq | CUT&Tag |
|
甲醛交联 |
是 | 否 |
|
超声破碎 |
是 | 否 |
|
方法获取片段化DNA方法 |
超声打断 | 使用Tn5转座酶 |
|
细胞起始量 |
10-10^7 | 单细胞 5*10^5 |
| 测序深度 | 20-50M reads | 3-5 M reads(低丰度靶点可尝试增加) |
| 是否需要完整的建库流程 | 需要 |
不需要 |
|
(T5可直接在DNA片段两喘加测序接头,一次PCR增即可) |
||
|
完成时间 |
≤1周 | 1-2天 |
|
二抗 |
常规不使用 | 使用 |
|
细胞核提取 |
需要 | 非必须 |
ChIP-Seq的劣势:⾸先,ChIP需要较多的细胞量,免疫共沉淀需要⾜够的靶标蛋⽩,⽽靶标蛋⽩有限的情况下就需要提供⼤量的细胞;其次,信噪⽐低,很多转录因⼦和染⾊体的结合相对松散,需要甲醛强交联,以防⽌后续洗涤过程破坏这些结合,这样导致很多⾮特异性信号,需要更⾼的数据量得到真实peak值;此外,实验的打断条件、重复性差等都需要系统的摸索才能得到较好的结果。这些因素综合起来导致ChIP对新⼿⾮常不友好,需要采购特定的设备、很⻓时间的预实验才能得到满意的结果。CUT&Tag技术,它免去了甲醛交联、超声破碎和免疫共沉淀的过程,这样既节省了初始实验材料⼜提⾼了信噪⽐、提升了实验可重复性。
2、为获得更全面的信息,CUT&Tag方法常与哪些技术联用?
● RNA-seq:将CUT&Tag与RNA-seq技术联用可以同时研究DNA结合蛋白与基因表达之间的关系。通过结合CUT&Tag获得的DNA结合蛋白的结合位点信息和RNA-seq分析的转录组数据,可以揭示特定DNA结合蛋白在基因调控中的作用,识别靶基因以及相关的调控网络。
● 蛋白质质谱(Proteomics):CUT&Tag方法可以与蛋白质质谱技术联用,以鉴定和定量与DNA结合蛋白相互作用的蛋白质。通过将CUT&Tag中所使用的特定抗体用于免疫沉淀,然后将沉淀的蛋白质进行质谱分析,可以鉴定与目标蛋白质相互作用的其他蛋白质,从而洞察蛋白质复合物的组成和功能。
● DNA甲基化分析:将CUT&Tag方法与DNA甲基化分析技术联用,可以研究DNA结合蛋白与DNA甲基化之间的相互关系。通过CUT&Tag分析获得的DNA结合蛋白的结合位点信息,结合DNA甲基化特异性的测序技术(如BS-seq或MeDIP-seq),可以探索DNA甲基化与蛋白质结合的调控机制以及其在表观遗传学中的作用。
● 转录因子蛋白-蛋白相互作用分析:CUT&Tag方法与蛋白质-蛋白质相互作用分析技术(如蛋白质质谱和免疫共沉淀)联用,可以研究转录因子蛋白与其他蛋白质之间的相互作用。通过分析蛋白质复合物的组成和动态变化,可以揭示转录因子蛋白在基因调控网络中的作用和调控机制。
这些联用技术可以提供更全面和深入的信息,帮助研究人员更好地理解DNA结合蛋白与染色质相互作用的复杂性。同时,结合不同的技术还可以验证和互相印证研究结果。
3、CUT&Tag方法的应用
● 基因调控研究:CUT&Tag方法可以揭示DNA结合蛋白在基因调控中的作用。通过识别DNA结合蛋白的结合位点和鉴定靶基因,可以了解特定转录因子蛋白的调控网络,从而深入研究基因的表达调控机制。
● 表观遗传学研究:CUT&Tag方法可以用于研究DNA结合蛋白与染色质上的表观遗传修饰(如DNA甲基化和组蛋白修饰)之间的相互作用。通过与DNA甲基化分析或组蛋白修饰分析的联用,可以揭示表观遗传修饰与DNA结合蛋白的协同调控作用,进一步了解表观遗传学调控对基因表达和细胞命运的影响。
● 染色质结构研究:CUT&Tag方法与染色质构象捕获(Hi-C)技术结合,可以探索染色质的三维结构。通过识别DNA结合蛋白的结合位点和染色质相互作用的区域,可以重建染色质的亚结构和互作网络,研究染色质的空间组织和基因调控机制。
● 细胞类型和发育过程的研究:CUT&Tag方法可以用于研究不同细胞类型和发育阶段的基因调控差异。通过分析DNA结合蛋白的结合位点和靶基因的表达模式,可以揭示不同细胞类型之间的转录因子调控网络差异和发育过程中的基因调控动态。
● 疾病研究:CUT&Tag方法在疾病研究中也有重要应用。通过比较疾病样本与正常样本中DNA结合蛋白的结合位点和基因表达的变化,可以鉴定与疾病相关的调控元件和靶基因,深入了解疾病的发生机制和治疗靶点。
总的来说,CUT&Tag方法在基因调控、表观遗传学和染色质三维结构等领域的应用非常广泛。它提供了高空间分辨率的DNA结合蛋白结合位点信息,帮助研究人员深入理解基因调控、表观遗传学和染色质组织等重要生物学过程。通过CUT&Tag方法,研究人员能够揭示基因调控网络、表观遗传修饰与DNA结合蛋白的相互作用以及染色质的三维结构。这些研究对于理解细胞发育、疾病发生机制以及开发新的治疗策略具有重要意义。










