蛋白质组学分析
- 标准化流程
- 多项自主研发专利
- 万例个生物样本项目经验
服务特色
金开瑞蛋白质组学平台引进了先进的SCIEX TripleTOF 5600 + 液质联用系统、 Q Exactive™ HF 组合型四极杆-Orbitrap MS,为您提供蛋白质鉴定、定量蛋白质组、磷酸化蛋白质组等全方位的蛋白质组学相关服务。 金开瑞拥有稳定的实验方案,严格的质控标准,专业的技术团队,保证您的实验达到最优效果。自平台成立至今,我们服务了300+家高校、科研院所、医院,遍布全国各地;完成了万例个生物样本,分析的物种达150种,囊括了从模式生物到普遍高等动植物到细菌、真菌和病毒等几乎所有类型物种
服务介绍
蛋白质组学平台引进了先进的SCIEX TripleTOF 5600 + 液质联用系统、 Q Exactive™ HF 组合型四极杆-Orbitrap MS,为您提供蛋白质鉴定、定量蛋白质组、磷酸化蛋白质组等全方位的蛋白质组学相关服务。
金开瑞拥有稳定的实验方案,严格的质控标准,专业的技术团队,保证您的实验达到最优效果。自平台成立至今,我们服务了300+家高校、科研院所、医院,遍布全国各地;完成了万例个生物样本,分析的物种达150种,囊括了从模式生物到普遍高等动植物到细菌、真菌和病毒等几乎所有类型物种;涉及的样本类型从动物各类组织器官、各种细胞系、植物各类组织以及多种动物体液(血液、尿液、脑脊液、唾液、毒液等)到微生物菌体及病毒。
服务优势
- 领先的质谱、色谱系统,为全面开展蛋白质组学技术提供高稳定性、高重复性以及高可靠性的系统解决方案。
- 独立的研发部门,并由经验丰富的博士带队,研发了多项自主技术流程,包括实验流程优化以及生物信息分析流程等,拥有多项自主研发专利、软件著作权。
- ISO9001体系管理,严格质量控制,每个环节都有严格监控指标及详尽的实验记录,所有实验过程有据可查。
- 常规项目至多30个工作日可以交付;在服务过程或项目结项后,客户有任何疑问,会在2小时内提供答复,在最晚2个工作日内提出解决方案。
常见问题
金开瑞蛋白质组学平台引进了先进的SCIEX TripleTOF 5600 + 液质联用系统、 Q Exactive™ HF 组合型四极杆-Orbitrap MS,为您提供蛋白质鉴定、定量蛋白质组、磷酸化蛋白质组等全方位的蛋白质组学相关服务。稳定的实验方案,严格的质控标准,专业的技术团队,保证您的实验达到最优效果。 自平台成立至今,我们服务了400+家高校、科研院所、医院,遍布全国各地;完成了万例个生物样本,分析的物种达180种,囊括了从模式生物到普遍高等动植物到细菌、真菌和病毒等几乎所有类型物种;涉及的样本类型从动物各类组织器官、各种细胞系、植物各类组织以及多种动物体液(血液、尿液、脑脊液、唾液、毒液等)到微生物菌体及病毒。
金开瑞目前使用的是ABSCIEX的5600 plus质谱仪和 Q Exactive™ HF 组合型四极杆-Orbitrap MS。仪器性能:1灵敏度高:达到高端QQQ的MRM的定量灵敏度;2高分辨:全质量范围内至少30000的分辨率;3高质量准确度:外标1 ppm;4超快的分析速度:扫描速度每秒一百张MS或MS/MS图谱,是其它高分辨质谱的5-10倍,达到三重四级杆MRM的扫描速度;5定量线性范围宽:超过4个数量级。
金开瑞蛋白质组学平台可接收的样本包括胶点/胶条、蛋白溶液、动物组织、植物组织、真菌、细菌、细胞样品、体液样品、血清/血浆等,还可接收石蜡切片等特殊样本。具体样本需求量和注意事项,请参考《金开瑞蛋白质组学样品准备注意事项》 细胞、组织、蛋白溶液、菌体等样品最好采用干冰运输,对于SDS-PAGE条带和2D点以及酶解好的肽段样品直接常温运输即可。可以理解为需要提取蛋白或提取好的蛋白样品(易降解)都需要低温运输,而处于凝胶中的蛋白或者是酶解好的肽段可常温运输。
可以大规模鉴定特定组织、细胞等各种样本的蛋白质种类、修饰状态以及蛋白质之间的相互作用,以及对这些蛋白质功能分析、分类; 可以对不同条件下某一特定样本进行大规模的蛋白质(包括翻译后修饰蛋白)表达量变化分析,筛选潜在biomarker,筛选重要信号通路; 依托大样本量,可以实现疾病的分子分型分析、重要潜在靶标鉴定。
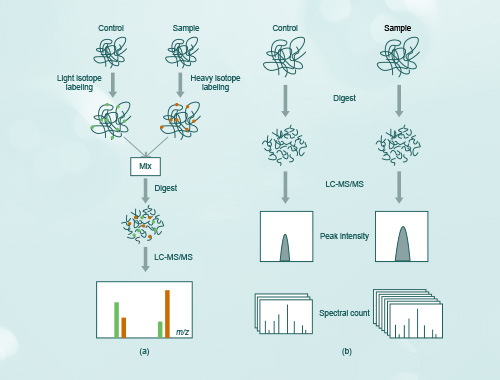
两种方法侧重点不同,基于质谱的蛋白质组学技术一般是用来做高通量发现、筛选潜在biomarker、蛋白互作研究、大规模翻译后修饰水平研究;基于芯片的方法往往是大规模研究或验证已知蛋白蛋,做定量分析、蛋白互作分析等。前者属于无目的性的研究所有蛋白,然后筛选感兴趣蛋白。后者属于已经知道感兴趣蛋白,然后做进一步研究。
若有对应物种的全基因组并有预测的全蛋白序列库,可优先选择全蛋白序列库;若无全蛋白序列库,有对应物种对应组织(器官等)的转录组测序结果并,可以使用转录组的测序结果(mRNA三框翻译或者预测CDS,并翻译成氨基酸序列);若基因组、转录组数据库都没有,优先选择同源性最接近的物种的全蛋白数据库,若近源物种没有合适的全蛋白库,则选择更大的蛋白全库(如动物全库、绿色植物全库、微生物库等)。
因为当前大量的物种已经测序,预测了相应的基因,未测序的物种可以通过近缘物种的基因序列作为数据库进行蛋白质组的研究。因此,一般来说,未测序物种可以考虑近缘物种的基因组序列作为数据库,可以做蛋白质组。
因抗体质量问题,IP实验本身存在假阳性,此种情况质谱能检测到目标蛋白的概率较低;若IP实验没问题,但质谱未鉴定到目标蛋白的可能原因有:① 目标蛋白与抗体结合不强,IP洗脱时因太过剧烈导致实际结合的目标蛋白非常少,达不到质谱要求的灵敏度;② 样品中存在高丰度污染蛋白,其信号覆盖了目标蛋白的信号,导致未能鉴定到。解决方案:调整IP实验,如更换抗体(不同厂家更换)、改变洗脱策略(由剧烈变缓和),实验过程严格控制操作环境,避免引入大量污染蛋白。
生物学重复是指不同生物个体或者不同生物群体的样品之间进行地相同处理而进行的实验,而技术重复是指同一样品进行的多次相同实验。举例:对来自三只健康小鼠A、B、C的血清样品分别各进行一次双向电泳,这三次双向电泳就是生物学重复;而取其中一只小鼠的血清样品进行三次双向电泳,或者将三只小鼠的血清混合后的样品进行三次双向电泳,这三次实验就是技术重复。总结生物学重复的样品来自不同的个体或者是群体,重复之间样品不同;而技术重复的几次实验的样品完全相同,可以来自单一个体,也可以是多个个体的混合样品,但用于重复实验的样品完全一样。
Label free需要进行三次重复,而iTRAQ、TMT一般也建议您做3次实验重复,如果实验方案后期设计了大量的验证实验如WB或ELISA等,最好做也能做两次重复;如果不进行重复实验后期的验证实验也少,在后期发表文章的时候结果可能会受到一些审稿人的质疑,从而影响文章的发表,特别是一些高分杂志较为突出。 如果是进行技术重复,各实验结果之间的数据重复性会更好,而生物学重复由于多种原因可能导致重复性与偏差或者不好,一般情况下Label free最好使用技术重复,这样有利于后续数据的分析,而其他是实验可以采用生物学重复或者技术重复。代谢组根据样品的不同选择合适的数量进行生物学重复。
由于生物学样本,本身之间就具有个体差异,我们不能保证任何两者的比值的皮尔森相关系数都能达到0.8以上,但保证结果质量符合一般杂志要求。
全谱分析和定量分析它们分别能鉴定到的蛋白数,跟样品的复杂度和样品制备方法有较大关系。一般情况下,常规样本全谱分析能鉴定到1000~3000个蛋白,定量蛋白质组学能鉴定到2000~6000个蛋白。
验证方法包括WB、IHC、q-PRC,以及基于质谱的PRM等。不一致时,首先考验证方法、操作是否有问题(可重复做);还可以考虑换其他验证方法;实在不行,需要考虑组学定量结果可能存在假阳性,需要重现筛选差异靶点。
需要研究人员根据自己研究的相关生物学背景,再结合生物信息学分析的结果,以及查看相关的文献资料来确认哪些蛋白可以用于后续深入的研究。
目前一般文献中的分析主要为维恩图分析、热图分析、火山图分析、层次聚类分析、蛋白质功能分析(GO分类为主)、蛋白质所属代谢通路富集分析(基于KEGG的pathway)、差异蛋白互作网络构建、转录因子预测等方面。 其它一些比较特异的高级分析包括多组数据关联分析、多pathway延伸分析、磷酸蛋白激酶预测分析、互作网络及生物调控模型构建分析。
常见期刊包括有MCP (molecular & cellular proteomics), JPR(journal of proteome research), Proteomics, Journal of Prteomics, Electrophoresis, Plos One, BMC Genomics, Expert Rev Proteomics, BMC Syst Biol, OMICS, Proteomics Clin Appl, Proteome Sci等。
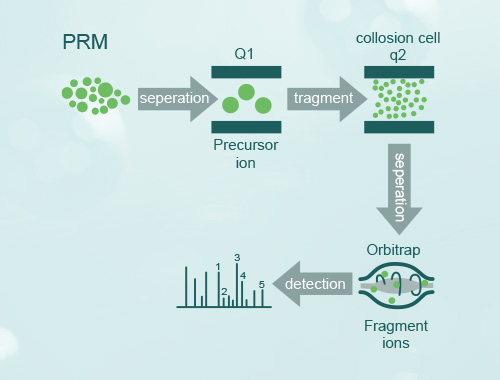
基于质谱多反应监测(Multiple Reaction Monitoring,MRM)技术的目标蛋白分析,可以有目标地分析检测那些被认为可能与特殊功能相关的关键蛋白在大规模样本中的表达量。 工作原理是,基于已知信息或假定信息设定质谱检测规则,对符合规则的离子进行信号记录,去除大量不符合规则离子信号的干扰,是一种高特异性、高灵敏度的质谱数据获取方式。
全谱分析和定量分析它们分别能鉴定到的蛋白数,跟样品的复杂度和样品制备方法有较大关系。一般情况下,全谱分析能鉴定到1000~2000个蛋白。由于定量分析在获得的谱图上会比全谱分析少20%,因此,定量分析可能会比全谱鉴定到的蛋白数少些。 蛋白全谱分析:常规样本,1000~3000(具体跟物种、样本类型有关系); 定量蛋白组学:常规样本2000-6000(具体跟物种、样本类型以及组学技术挂钩)。
1. 虽然这两个库的目的都是为了找的描述上的标准化,但是它们是由不同的组织机构整理的,你可以观察到哪怕同一个过程,GO和KEGG的基因都不一样,因为人们对它的理解都不同。不仅如此,不同的通路数据库之间的收集整理都不一样。2. GO偏向于分子的共同属性(比如都参与到了水解过程)的整理归纳,而且GO数据库是通过对共同属性进行的级层管理,比如一个公司有好多自上而下的管理部门,大的管小的,你分子只要是这个部门的就行,不管分子之间关系如何;而KEGG偏重于 部门内部的关系,谁和谁关系好(激活),谁和谁关系差(抑制),谁和谁得通过谁传达任务(信号转导)。 所以,通过GO,你可以了解到一家公司的管理结构。通过KEGG,你可以了解一家公司的内部人和人之间的关系。3. 但是,你如果通过公共的数据库,是没有办法同时了解到二者可以完全吻合的信息,因为管理库的人不一样。所以,如果可以,你需要找到GO和pathway是同一个机构整理的数据库,这样才可以更完整的把这家“公司”的信息搞明白。
只要物种在蛋白质组数据库中存在足够多的数据、基因组已知或 EST(或转录组)数据足够丰富,均可进行蛋白质组全谱分析。对以上条件均不满足的物种,可在进行蛋白质组全 谱分析的同时,做一个基因组或转录组测序,以便为蛋白质组全谱分析提供支持。因此,理论上,所有的物种均可进行蛋白质组全谱分析。