实验原理
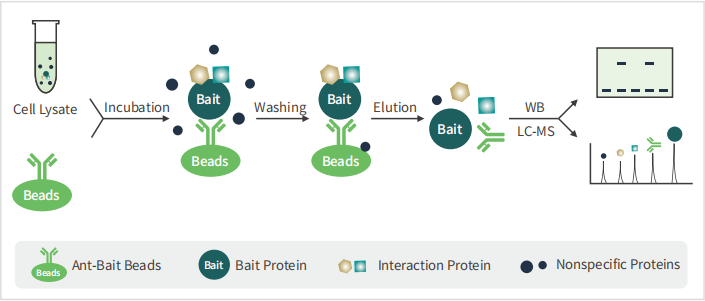
免疫共沉淀(Co-lmmunoprecipitation)是利用抗原与抗体之间的专一性作用为基础,从而用于研究蛋白质与蛋白质之间相互作用的一种方法。抗体与裂解液中相应的蛋白结合后,再与ProteinA/G偶联的Sepharose或MagneticBeads孵育,通过离心或者借助磁力架获得ProteinA/G磁珠-抗体-目的蛋白复合物,在高温及还原剂的作用下,抗原与抗体解离,收集上清,上清中包括抗体、目的蛋白和少量的杂蛋白,再通过Western Blot或质谱(MS)鉴定蛋白质。其原理图如下:

产品优势
• 精准捕获:对磁珠和缓冲液进行优化升级,确保靶蛋白及其互作蛋白的高效富集,降低非特异性结合。
• 低背景设计:优化洗脱液和洗涤方案减少干扰信号,提升弱相互作用的检出率,适合低丰度蛋白研究。
• 标准化流程:详细步骤说明书(含有操作视频链接),新手也能快速上手,减少优化时间。
• 操作简便:节省时间、结果客观准确。
应用范围
• 蛋白质相互作用验证
• 鉴定多蛋白复合物的成员(如转录调控复合物、酶复合物或病毒-宿主蛋白复合物)。
• 翻译后修饰研究:分析磷酸化、泛素化等修饰对蛋白互作的影响,常结合质谱或特异性抗体使用
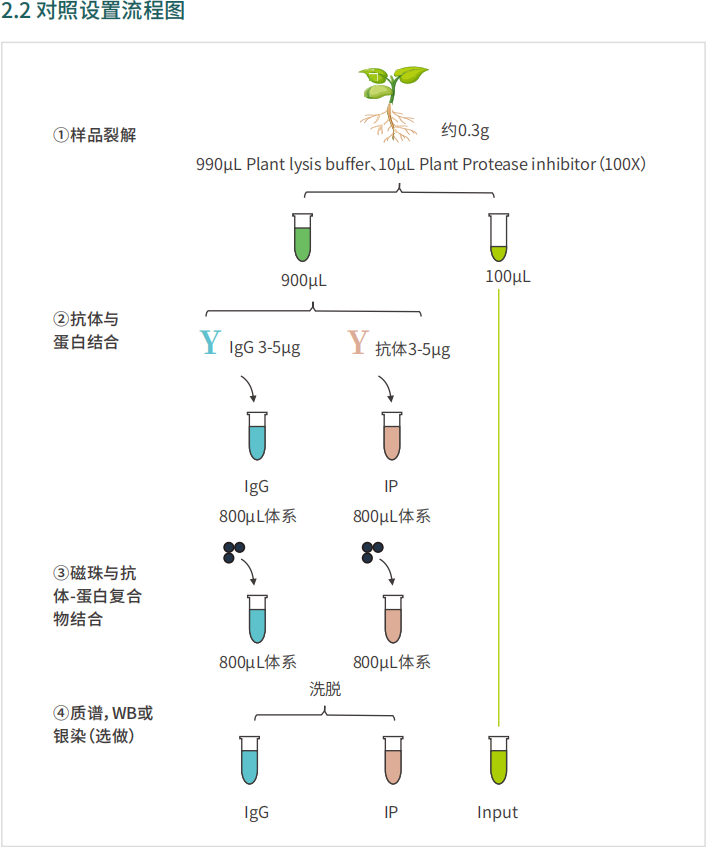
实验流程
试剂盒组分
|
组分 |
容量(6T) | 保存温度 |
|
Plant lysis buffer |
9mL | 4°C |
|
ProteinA/G Magnetic Beads |
200uL | 4℃ |
|
Incubation buffer |
4.5mL | 4℃ |
|
Wash buffer |
20mL | 4℃ |
|
Elution buffer |
70OuL | 4°C避光 |
|
Plant protease inhibitor(100 X) |
35uL | -20°C |
|
Normal Rabbit IgG (1mg/mL) |
3OuL | -20C |
|
Normal Mouse IgG (1mg/mL) |
3OuL | -20°C |
特别提醒1:需自备PBS、6Xloading buffer、磁力架等试剂耗材。
特别提醒2:6T为6次单组(1组IP或1组IgG)免疫沉淀实验,后面的操作步骤中包含了IgG和IP各1组,
需消耗2T试剂。
常见问题与解答
Q1:通过CoIP后WB验证发现,没有想要的目的条带?
A:多方面原因造成:
1)有可能是样品被蛋白酶降解,对应的策略是需要添加蛋白酶抑制剂,所有操作保持4℃以下冰上操作且避免反复冻融。
2)有可能是抗体浓度太低导致条带较浅,则需要调整IP或WB抗体浓度,必要时设立浓度梯度,摸索最佳浓度。
3)抗体亲和力太低,选用适合于IP或者WB的抗体。
4)有的IP抗体未与磁珠结合,这种情况需选用适合IP的磁珠。
5)若Tag未暴露在融合蛋白构象的表明,则需改变Tag融合表达部位。
6)裂解液盐碱度太高,需用低盐碱度的裂解液。
7)抗体选择不当,更换抗体。
Q2:通过CoIP后WB验证发现,虽然可见目的条带,但是背景很高:
A:多方面原因造成:
1)由非特异带白结合导致背景高,若要避色主特异性带白结合,则需要在无血清溶液中裂解细胞,且在免疫沉淀前用protein(A/G)磁珠预洗免疫沉淀后增加漂洗次数和盐碱度(高盐或去垢剂)。
2)实验仪器或试剂被污染,使用洁净的仪器及实际。
3)转移膜上的目特异吸附导致背景高,实验操作过程中载手套,使用镊子来取,不要接触膜转移面。
4)制备样品中可能有不完全溶释的大的蛋白复合体,则在制备样品后进行知暂超声处理(3次,每次5秒钟 ),然后离心,取上清后进行后续试验。
5)洗涤不彻底,则需要多次洗涤,并设新增加洗涤液中的NaCl和去垢剂浓度。
6)可能有非特异性蛋白吸附于珠子上,则须进行Preclearing以排非特异性吸付。
7)抗体本身待异性不好可能导数者景高,则须选择合适的抗体,可以考虑单抗。
8)使用了过多的细胞或组织进行裂解导致背景高,则须减少样本量,推荐100-500ug细胞裂解物。
9)蛋白降解也可能出现高背景的情况,尽量使用新鲜制备的样品。
相关产品
⇒ 银染试剂盒(Silver Stain Kit) ⇒ Co-IP试剂盒(植物)
⇒ DNA pull-down试剂盒(动物) ⇒ DNA pull-down试剂盒(植物)
相关技术服务
► 双荧光素酶报告系统 ► 酵母双杂交 ► EMSA ► RNA pull-down
► RIP-qPCR ► DNA pull-down ► ChIP-qPCR ► 酵母单杂交