客户文献分享,IF>11|Shank3:脑缺血再灌注损伤的守护者,揭示神经保护的新篇章
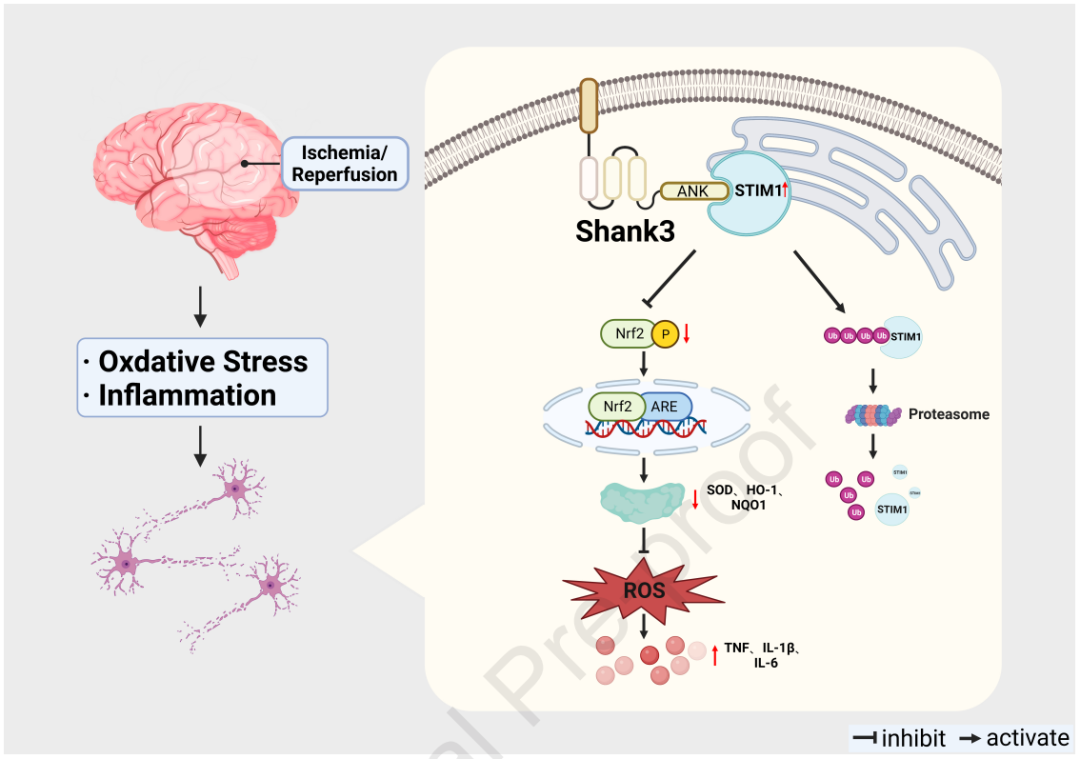
Shank3 是一种与自闭症发展和恶化相关的关键分子,最近发现在小鼠缺血/再灌注 (I/R) 后脑组织中的表达下调。然而,其对I/R后神经元损伤的影响及作用机制仍有待阐明。研究者发现Shank3在I/R后的表达呈时间依赖性变化。而条件性敲除(cko)Shank3会导致神经元损伤加重。进一步研究揭示,Shank3在I/R后通过直接与STIM1结合,促使STIM1经蛋白酶体介导降解,发挥保护神经元免受氧化应激和炎症伤害的作用。STIM1的下调能够增加下游Nrf2的磷酸化水平,进而转移到细胞核,促进抗氧化基因NQO1和HO-1等表达。体内研究表明,STIM1的敲除减轻了I/R后Shank3cko小鼠的氧化应激和炎症。总体而言,本研究揭示了Shank3与STIM1相互作用,并通过Nrf2途径抑制I/R后神经元的氧化应激和炎症反应,为潜在的I/R治疗方法的发展提供了理论支持。
研究结果
01、Shank3在体内和体外缺血/再灌注(I/R)损伤后呈现出时间依赖性的调节
为模拟体内中风后的I/R损伤,小鼠进行tMCAO 1小时后再灌注。据报道,在啮齿类动物大脑中,海马体对I/R损伤相当敏感,因此我们重点关注了海马体的Shank3表达。海马体Shank3的表达在缺血和再灌注过程中表现出时间依赖性变化。Shank3在缺血后下降,再灌注期间开始上升,并在6小时达到峰值,之后下降。海马体Shank3的免疫荧光染色表明,与Sham组相比,缺血和I/R组中的Shank3显著下调。此外,氧和葡萄糖剥夺(OGD)也导致HT22细胞中Shank3表达下降,再灌注后有所上升,但仍低于标准条件。这些结果表明I/R导致Shank3在体内和体外呈现出时间依赖性的波动,也暗示着Shank3在缺血再灌注损伤中发挥重要作用。
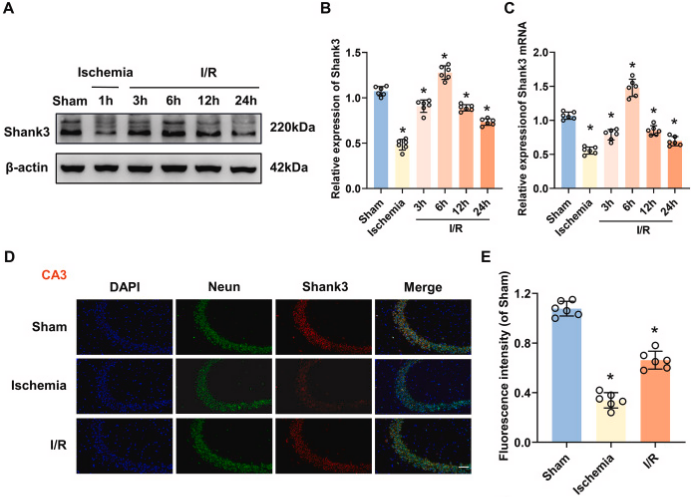
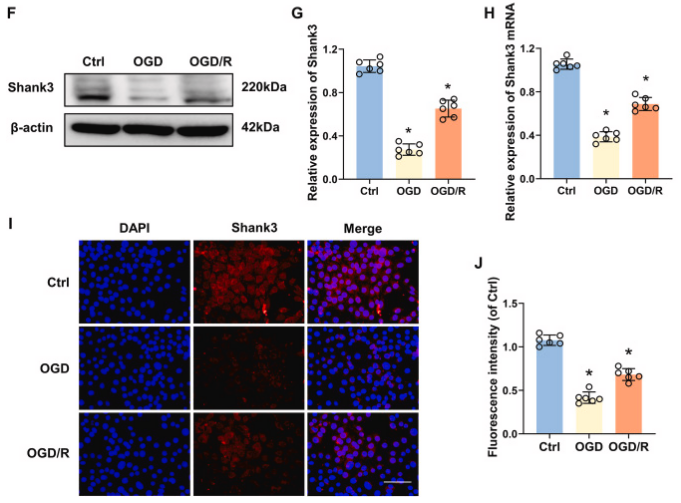
图1. Shank3在脑缺血再灌注损伤中的时空表达
A:小鼠海马体Shank3蛋白水平在I/R过程中的变化。B:Shank3的相对表达量随I/R时间而改变。C:Shank3的mRNA水平在I/R后发生变化。D:Shank3在海马体的定位和表达。E:Shank3的染色强度在I/R后发生变化。F:HT22细胞中Shank3蛋白水平在OGD和再灌注后的变化。G:Shank3的相对表达量在OGD/R处理后发生变化。H:Shank3的mRNA水平在OGD/R处理后发生变化。I:Shank3在HT22细胞的定位和表达。J:Shank3的染色强度在OGD/R处理后发生变化。
02、神经元特异性Shank3敲除通过促进神经元凋亡加重I/R后的脑损伤
为了深入探究Shank3在I/R诱导的神经元损伤中的作用,研究者利用Cre-LoxP重组技术构建了神经元特异性的Shank3敲除小鼠(Shank3cko),并验证了敲除效率。尽管Shank3cko小鼠表现出部分神经功能缺损,但Sham手术影响有限。与对照组相比,Shank3cko小鼠在I/R后表现出更严重的神经功能缺损、脑水肿和更高的梗死体积比。Western blot和免疫荧光实验结果显示,Shank3敲除后,抗凋亡标记物Bcl-2/Bax比值降低,而凋亡标记物cleaved-caspase3增加。Shank3敲除增加了I/R后海马体中TUNEL阳性细胞的数量。这些结果表明,神经元中Shank3的敲除加重了I/R后的脑损伤,并通过促进神经元凋亡导致神经功能恶化。
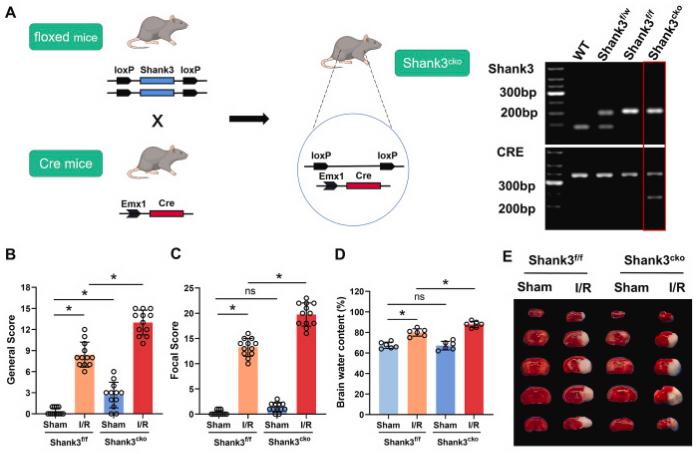
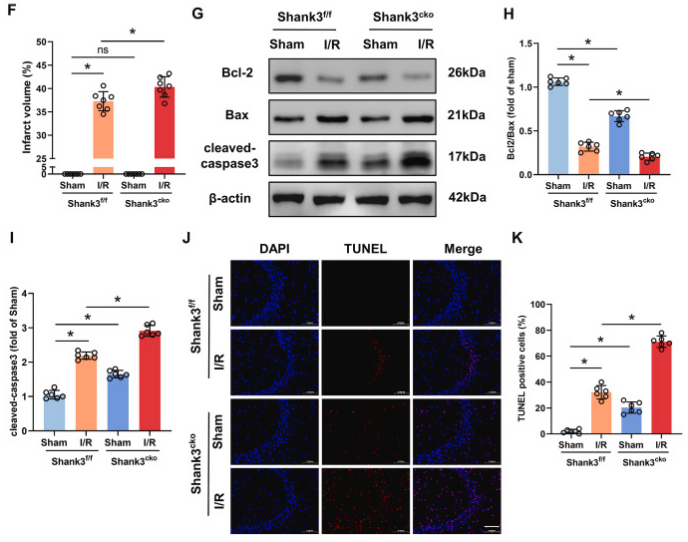
图2. Shank3敲除加剧缺血性脑损伤
A:构建Shank3的条件性敲除小鼠。B, C:I/R后,Shank3敲除小鼠的Clark评分显著高于对照组,显示总体和局灶性神经功能缺损。D:脑水肿程度在Shank3敲除小鼠中加重。E, F:TTC染色显示Shank3敲除小鼠的大脑梗死区域更大。G-I:Western blot分析显示Shank3敲除后,凋亡标记物增加,抗凋亡标记物减少。J:海马体的共聚焦图像显示在Shank3敲除小鼠中更多的TUNEL阳性细胞(凋亡细胞)。K:TUNEL阳性细胞数量在Shank3敲除小鼠中显著增加。
03、Shank3的缺失加剧体内I/R后的氧化应激和炎症
本研究探讨了Shank3对氧化应激和炎症的影响,考虑到氧化应激和炎症在I/R诱导的神经元凋亡中的作用。与Sham组相比,Shank3f/f小鼠大脑中ROS和丙二醛(MDA)等脂质过氧化产物的水平在I/R后显著增加,而Shank3敲除则进一步加剧了这一现象。另一方面,抗氧化剂如GSH-Px、GSH、CAT和SOD的水平在Shank3敲除后显著降低。此外,条件性敲除Shank3后,促炎细胞因子TNF、IL-1β和IL-6也显著增加。血清中细胞因子水平的测量显示,Shank3敲除与组织中的变化趋势相似。综上所述,敲除Shank3加剧了I/R后体内海马体神经元的氧化应激和炎症。
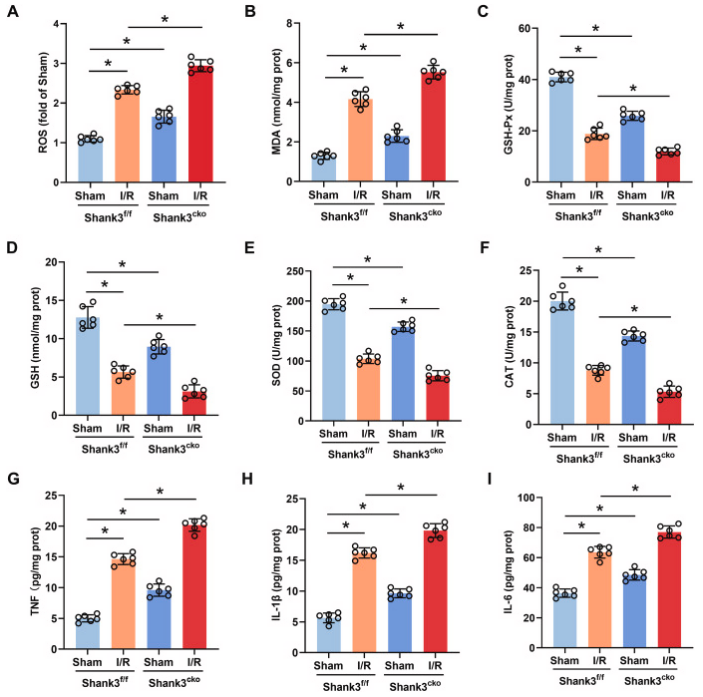
图3. Shank3的缺失加重I/R后的氧化应激和炎症
A-I:收集I/R后的海马体组织并匀浆,以测定ROS、MDA、GSH-Px、GSH、SOD、CAT、TNF、IL-1β和IL-6的水平。
04、Shank3在体外抑制OGD/R后的细胞凋亡、ROS产生和炎症
为了阐明Shank3对缺血再灌注诱导的细胞损伤的保护作用,在HT22细胞中,通过shRNA敲低和慢病毒过表达Shank3,然后进行OGD/R处理。与体内实验结果一致,Shank3的缺乏增加了凋亡蛋白cleaved-caspase3,降低了Bcl-2/Bax比率和细胞活力,通过TUNEL染色也观察到细胞凋亡的增加。此外,敲低Shank3显著增加了ROS和MDA,并降低了抗氧化剂GSH-Px、GSH和SOD的产生。OGD/R处理后,HT22细胞中TNF、IL-1β和IL-6等促炎细胞因子的表达增加,由于Shank3的缺乏,其表达进一步显著增加。这些由OGD/R和Shank3敲低引起的有害效应部分可以通过Shank3过表达得到逆转。总的来说,这些结果表明Shank3对OGD/R诱导的氧化应激和炎症具有保护作用。
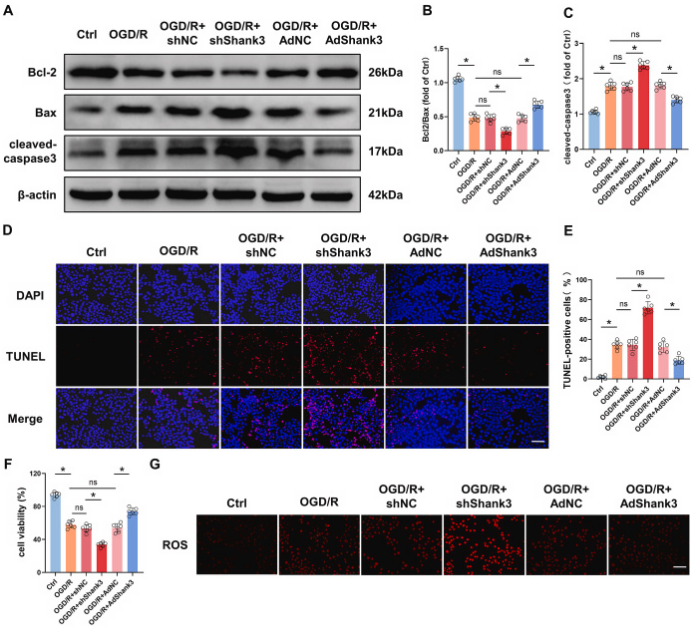
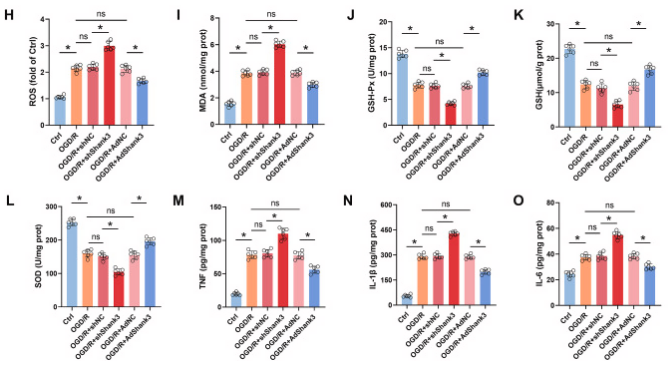
图4. 敲低Shank3对OGD/R后HT22细胞中细胞毒性和凋亡的影响
A-C: Shank3对Bcl-2/Bax和cleaved-caspase3的影响。D和E: TUNEL染色显示凋亡细胞的数量。F: Shank3提高HT22细胞的存活率。G和H: Shank3降低ROS的产生。通过荧光染色观察并量化ROS水平,显示Shank3能抑制I/R诱导的氧化应激。I-O: Shank3对氧化应激和炎症反应的调节。结果显示Shank3降低MDA(氧化应激标志物)、提高抗氧化酶(如GSH-Px、GSH和SOD)的表达,并降低炎症因子(如TNF、IL-1β和IL-6)的表达。
05、Shank3与神经元中的STIM1直接相互作用
通过对Shank3cko和Shank3f/f小鼠海马体进行RNA-Seq分析,揭示了Shank3对下游信号传导的影响。GO分析显示,与钙离子结合相关的基因表达得到富集。GSEA表明,负调控细胞质钙离子浓度的基因集发生了显著变化。我们之前的研究发现STIM1的表达增加与神经氧化损伤和细胞凋亡相关,而抑制STIM1缓解了钙超载介导的神经损伤。通过分子对接实验,确定了Shank3的ANK结构域与STIM1的SOAR结构域之间的直接相互作用。免疫荧光实验证明Shank3和STIM1主要共定位在海马体神经元的细胞质和细胞膜上。免疫共沉淀和GST pull-down实验证实了它们之间的蛋白质相互作用,敲除ANK结构域预测的结合位点导致相互作用减弱。Shank3过表达降低STIM1水平,而Shank3敲除增加STIM1表达,表明Shank3对STIM1的表达具有负调控作用。此外,Shank3通过泛素-蛋白酶体途径降解STIM1。这些结果表明,Shank3通过调节STIM1稳定性,发挥对I/R后神经氧化应激的保护作用,减少钙离子内流。
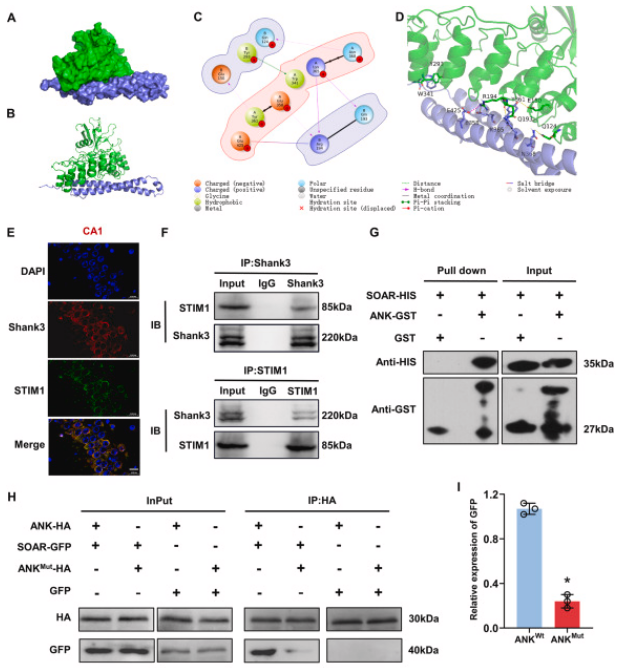
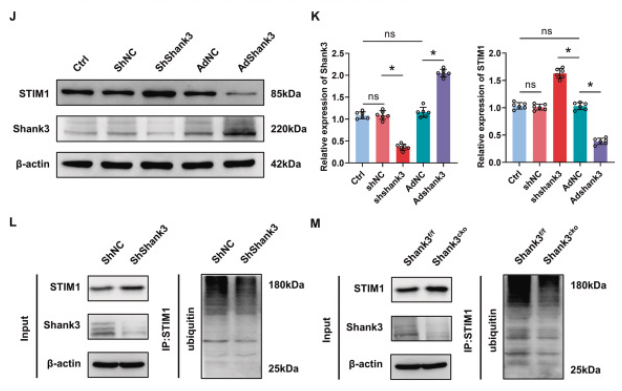
图5. Shank3对STIM1的调节作用
A、B: Shank3的ANK结构域与STIM1的SOAR结构域的结合概览。C、D: Shank3与STIM1结合模式的二维和三维预测分析。E: Shank3(绿)和STIM1(红)在海马体的荧光染色。F: 通过Co-IP实验证明了Shank3与STIM1之间的蛋白质相互作用。G: GST pull-down实验显示Shank3直接与STIM1结合。H、I: Shank3突变体显著减弱了Shank3与STIM1之间的蛋白质相互作用。J、K: HT22细胞中Shank3和STIM1的蛋白水平。L、M: Shank3敲低后STIM1的泛素化水平变化。
文中的GST pull-down检测由金开瑞合作完成
06、Shank3通过下调STIM1表达缓解了OGD/R诱导的神经细胞损伤
作者进一步探究了Shank3对OGD/R诱导的神经损伤的保护作用是否依赖于STIM1。降低STIM1表达部分逆转了Shank3敲除后OGD/R引起的Bcl-2/Bax比值下降和cleaved-caspase3表达上调。TUNEL染色和CCK-8实验证明,在STIM1和Shank3双敲除组中,相比于Shank3敲除组,细胞凋亡减少,存活率增加。这些结果表明,Shank3通过下调STIM1在体外减轻了OGD/R诱导的细胞损伤。
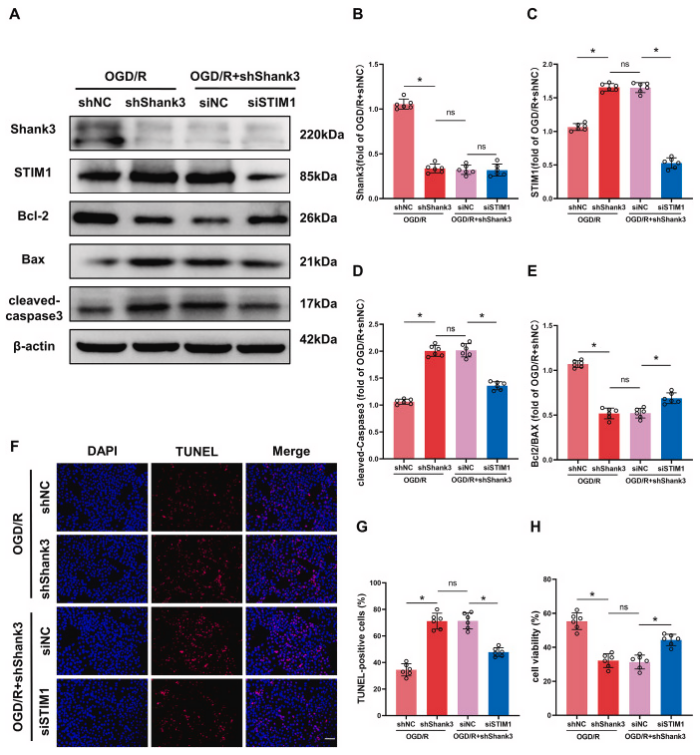
图6. STIM1的下调减轻了Shank3敲低后OGD/R诱导的细胞损伤
A-E: 在OGD/R后通过沉默STIM1影响Shank3敲除细胞中Shank3、STIM1、Bcl-2/Bax和cleaved-caspase3表达水平的变化。F、G: STIM1沉默对OGD/R后细胞凋亡的影响。H: STIM1沉默对细胞活力的影响。
07、Shank3/STIM1相互作用通过Nrf2磷酸化和核转位在OGD/R后发挥抗氧化应激作用
研究发现Shank3与STIM1的相互作用通过Nrf2途径对氧化应激和炎症反应产生保护作用。与shNC组相比,敲低Shank3增强了HT22细胞在OGD/R后的钙离子流入,而这一现象在STIM1沉默后得到显著逆转。钙离子流入增加导致calcineurin表达增加和Nrf2去磷酸化。Nrf2磷酸化减少抑制了Nrf2的核转位,从而减少了下游靶基因如NQO-1和HO-1的表达。然而,STIM1沉默逆转了Shank3缺陷对各种氧化剂/抗氧化分子的调节作用,包括ROS、MDA、SOD、GSH-Px、GSH和SOD,以及促炎细胞因子TNF、IL-1β和IL-6的升高。这些结果表明,Shank3/STIM1相互作用对OGD/R诱导的氧化应激和炎症活动的保护作用依赖于Nrf2的磷酸化和核转位。
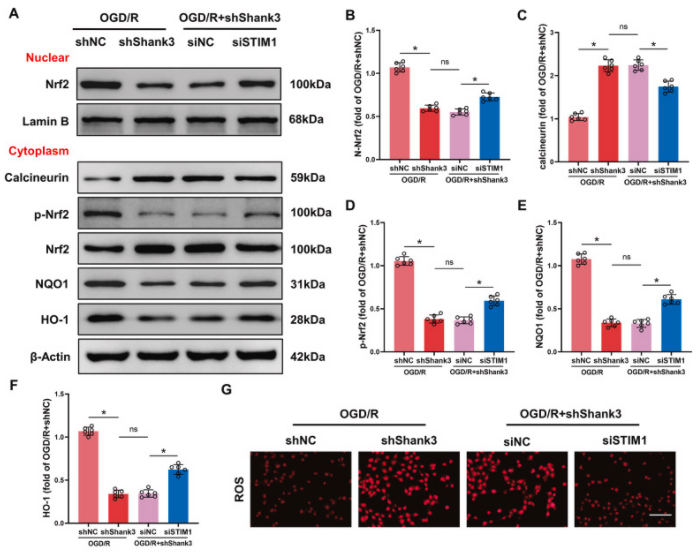
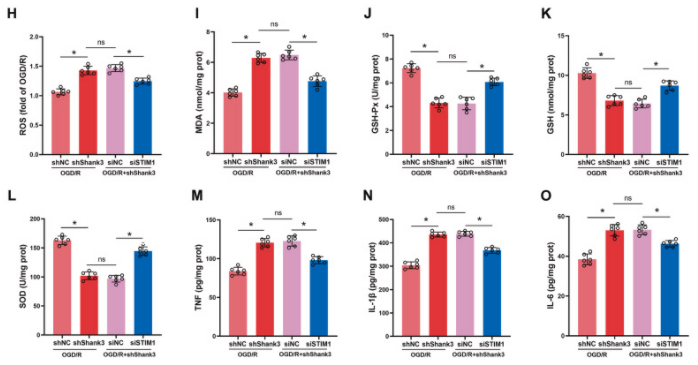
图7. Shank3/STIM1/Nrf2信号通路参与了OGD/R后Nrf2核转位和抗氧化应激活性
A-F:在经过OGD/R处理的细胞中通过Western blot分析Nrf2、calcineurin、p-Nrf2、NQO1和HO-1的蛋白水平。G、H:ROS水平的荧光染色图像和定量分析。I-L:对包括MDA、GSH-Px、GSH和SOD在内的抗氧化系统的分析。M-O:敲低STIM1对TNF、IL-1β和IL-6的影响。
08、敲低STIM1保护Shank3cko小鼠免受I/R诱导的脑损伤
为了研究Shank3/STIM1相互作用在脑缺血再灌注损伤中的作用,研究者对Shank3cko小鼠进行AAV9-STIM1-sgRNA或空载体病毒的注射,并进行tMCAO/R。STIM1沉默显著减轻了Shank3cko小鼠I/R后的脑损伤,包括梗死体积和脑水肿的减少。STIM1的下调逆转了Shank3缺失引起的细胞凋亡,提高了Bcl-2/Bax比值,降低了cleaved-caspase3水平和TUNEL阳性细胞数。同时,STIM1缺陷小鼠的ROS、MDA和炎症细胞因子水平下降,而抗氧化酶GSH-Px和SOD增加。总之,Shank3与STIM1的相互作用在I/R后对抗氧化应激和炎症反应中具有保护作用。
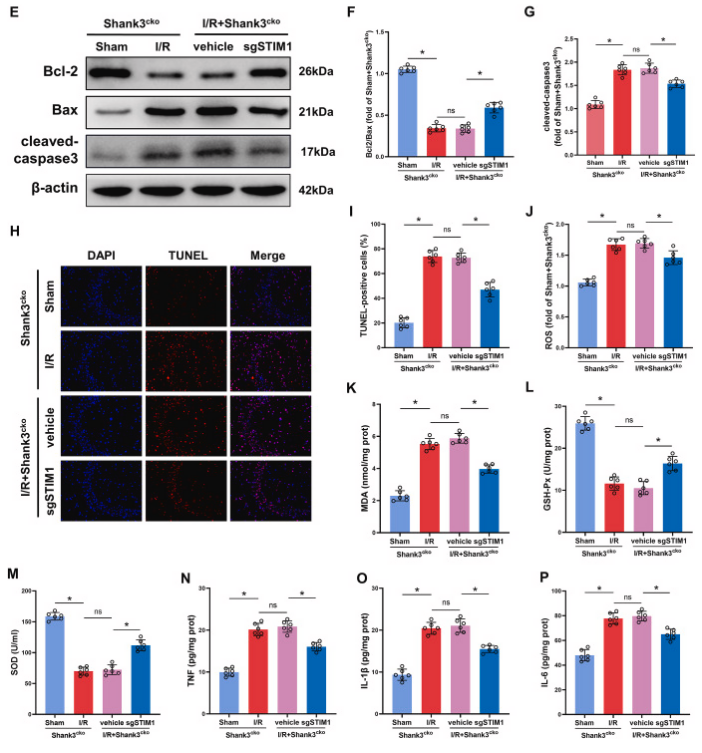
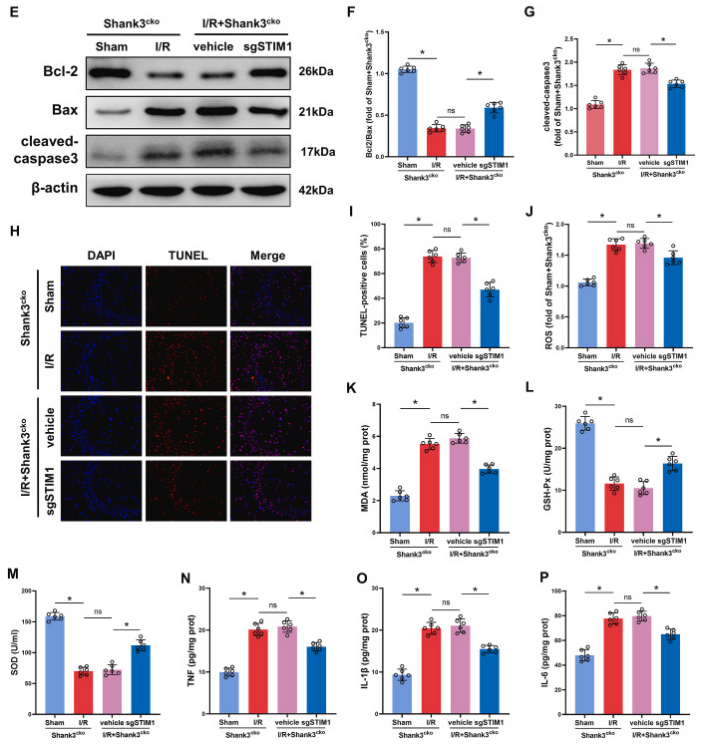
图8. 敲低STIM1缓解Shank3缺乏引起的缺血再灌注脑损伤
A、B:缺血再灌注后,Shank3缺乏的小鼠表现出明显的脑损伤,而敲低STIM1显著缓解了这种损伤。C、D:与对照组相比,Shank3缺乏的小鼠在缺血再灌注后梗死体积显著增加,而敲低STIM1减小了梗死体积。E-G:敲低STIM1增加了Bcl-2/Bax的比率,降低了cleaved-caspase3的水平,从而抑制了细胞凋亡。H、I:敲低STIM1显著减少了缺血再灌注后海马体的TUNEL阳性细胞数量。J-P:敲低STIM1降低了氧化应激和炎症指标的水平,具有抗炎和抗氧化作用。
总结
总之,本研究确定了Shank3在I/R诱导的神经元氧化应激和炎症中的作用,并揭示了Shank3/STIM1/Nrf2通路在其中发挥作用的机制,从而为I/R提供了一种有前景的治疗策略。
参考文献:https://doi.org/10.1016/j.redox.2023.102983
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










