双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
双荧光素酶报告基因实验(Dual-Luciferase Reporter Assay)是研究基因转录调控、信号通路激活以及非编码RNA靶向验证的关键分子生物学技术。该体系基于萤火虫荧光素酶(Firefly Luciferase)和海肾荧光素酶(Renilla Luciferase)两种报告基因,通过共转染至细胞中,分别检测目标启动子或3′UTR的转录活性或靶向调控效应。萤火虫荧光素酶作为实验报告基因,反映目标序列的调控活性;海肾荧光素酶作为内参,校正转染效率与细胞活性差异,确保结果的可靠性与重复性。
该技术具有灵敏度高、线性范围宽、操作便捷、适用性广等优势,已成为研究转录因子与DNA互作、miRNA与靶基因结合、信号通路调控等领域的“金标准”实验手段。
一、主要应用方向
1、验证miRNA与靶基因结合
将靶基因序列构建到萤⽕⾍荧光素酶基因3’区域,同时过表达microRNA。当microRNA与靶基因上特异结合位点结合后,将⼲扰荧光素酶mRNA的翻译或导致其迅速降解,使荧光强度降低;当结合位点被突变后,microRNA⽆法与靶基因结合,因此荧光值⽆明显变化。
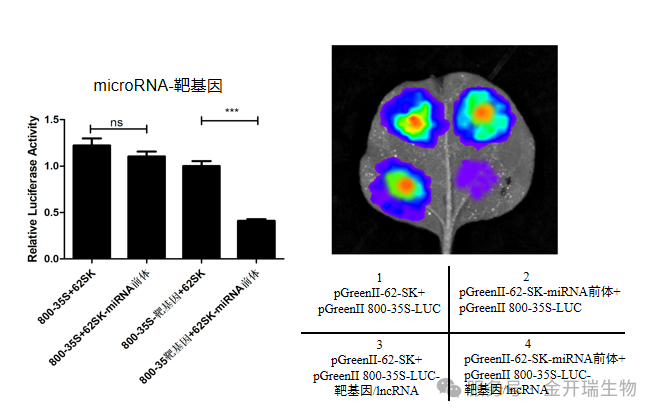
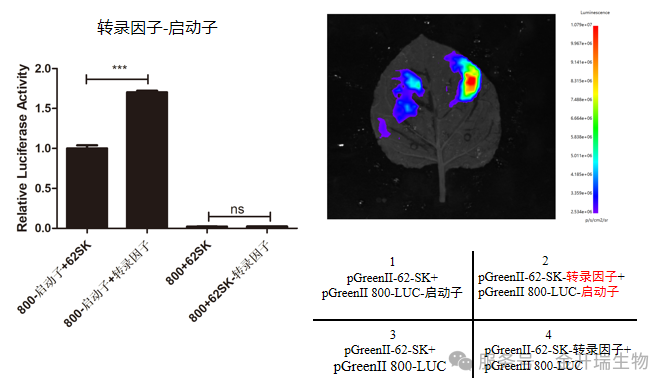
2、验证转录因子与启动子结合
将启动⼦序列构建到萤⽕⾍荧光素酶基因前,同时过表达转录因⼦。当转录因⼦与启动⼦上特异结合位点结合后激活荧光素酶基因转录,使萤⽕⾍荧光素酶得以表达,最终荧光强度上升;当结合位点被突变后,转录因⼦⽆法与启动⼦结合,因此荧光值⽆明显变化。
以下为金开瑞与多家科研团队合作发表的高水平研究中,双荧光素酶实验在解析分子机制中的关键应用案例。
案例1:验证肿瘤来源miRNA 对肌肉萎缩相关基因的靶向调控

2025年7月
期刊:Advanced Science (IF=14.1)
研究题目:Pancreatic Cancer-Derived Extracellular Vesicles Enriched with miR-223-5p Promote Skeletal Muscle Wasting Associated with Cachexia
研究背景:胰腺癌来源的胞外囊泡(EVs)可通过递送 miR-223-5p 促进肌肉萎缩,但其直接靶基因及调控方式尚不明确。
双荧光素酶实验设计:
为验证miR-223-5p 是否直接靶向 MAFA 基因的 3′UTR,研究构建了两种报告基因载体:一种携带 MAFA 3′UTR 的野生型序列,另一种则在预测的 miR-223-5p 结合位点引入突变。将报告基因载体分别与 miR-223-5p 模拟物(mimics)或对照共转染 C2C12 成肌细胞。
关键结果:
过表达miR-223-5p 可显著抑制野生型 MAFA 3′UTR 的报告基因活性,突变miR-223-5p 的结合位点后,其抑制效应完全消除。
科学意义:
该结果在分子水平直接证实了miR-223-5p 通过结合 MAFA mRNA 的 3′UTR 抑制其表达,阐明了胰管腺癌(PDAC)来源EVs 通过 miRNA 调控肌肉基因表达、导致萎缩的精确路径,为开发靶向治疗策略提供了新靶点。
案例2:阐明缺血性卒中神经元损伤的miRNA调控网络

发表时间:年7月
期刊:Journal of Advanced Research(IF:13.0)
研究题目:Endothelial cells secrete small extracellular vesicles to promote neuron endoplasmic reticulum stress injury via miR-146a-5p/Eif4g2 axis in ischemic stroke
研究背景:
内皮细胞来源的小细胞外囊泡通过传递miR-146a-5p促进神经元内质网应激损伤,但其直接靶基因及作用机制不明。
双荧光素酶实验设计:
为验证miR-146a-5p是否直接靶向Eif4g2的3'UTR,研究者构建了:野生型Eif4g2 3'UTR报告载体;突变型Eif4g2 3'UTR报告载体(突变miR-146a-5p结合位点)
实验结果:
miR-146a-5p模拟物显著抑制野生型Eif4g2 3'UTR的荧光素酶活性,突变结合位点后,miR-146a-5p的抑制效应消失,该结果在体内外模型中得到一致验证。
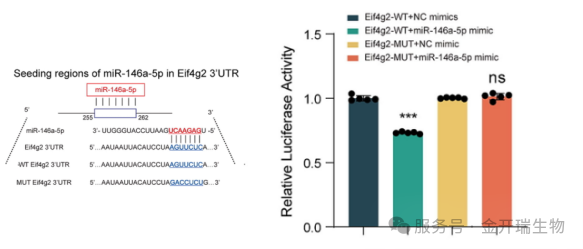
科学意义:
该实验证实Eif4g2是miR-146a-5p的直接靶基因,揭示了内皮细胞-神经元通过miRNA-靶轴调控内质网应激的新机制,为卒中治疗提供了新靶点。
案例3:揭示环境毒物诱导神经毒性的转录调控机制

发表时间:2024年9月
期刊:Journal of Hazardous Materials (IF=12.2)
研究题目:Targeting m⁶A mRNA demethylase FTO alleviates manganese-induced cognitive memory deficits in mice
研究背景:锰(Mn)暴露可导致学习记忆损伤,但其表观遗传调控机制不明。研究发现,Mn 通过影响转录因子 SOX2 的磷酸化,下调去甲基化酶 FTO 的表达,进而影响突触可塑性相关基因的 m⁶A 修饰与稳定性。
双荧光素酶实验设计:
为了探索Mn如何下调海马中FTO表达的机制,我们使用人和小鼠的JASPAR 、TFDB和GTRD 数据库来选择潜在的转录因子,确定了四种转录因子,SOX 2、GABPA、STAT 3和RUNX 1作为候选物,我们将FTO启动子克隆到编码荧光素酶的pGL 3基本载体中,然后将构建体与转录因子质粒和pRL-TK质粒一起转染到HEK 293 T细胞中,随后进行荧光素酶报告基因测定。
关键结果:
只有SOX2 可显著激活 FTO 全长启动子的报告基因活性,截短实验锁定其核心结合区域位于启动子−700bp 至−400 bp 区间。点突变该区域内预测的 SOX2 结合序列(“aaacaatagac” → “gggtgccgagt”)后,相对荧光素酶活性明显降低。
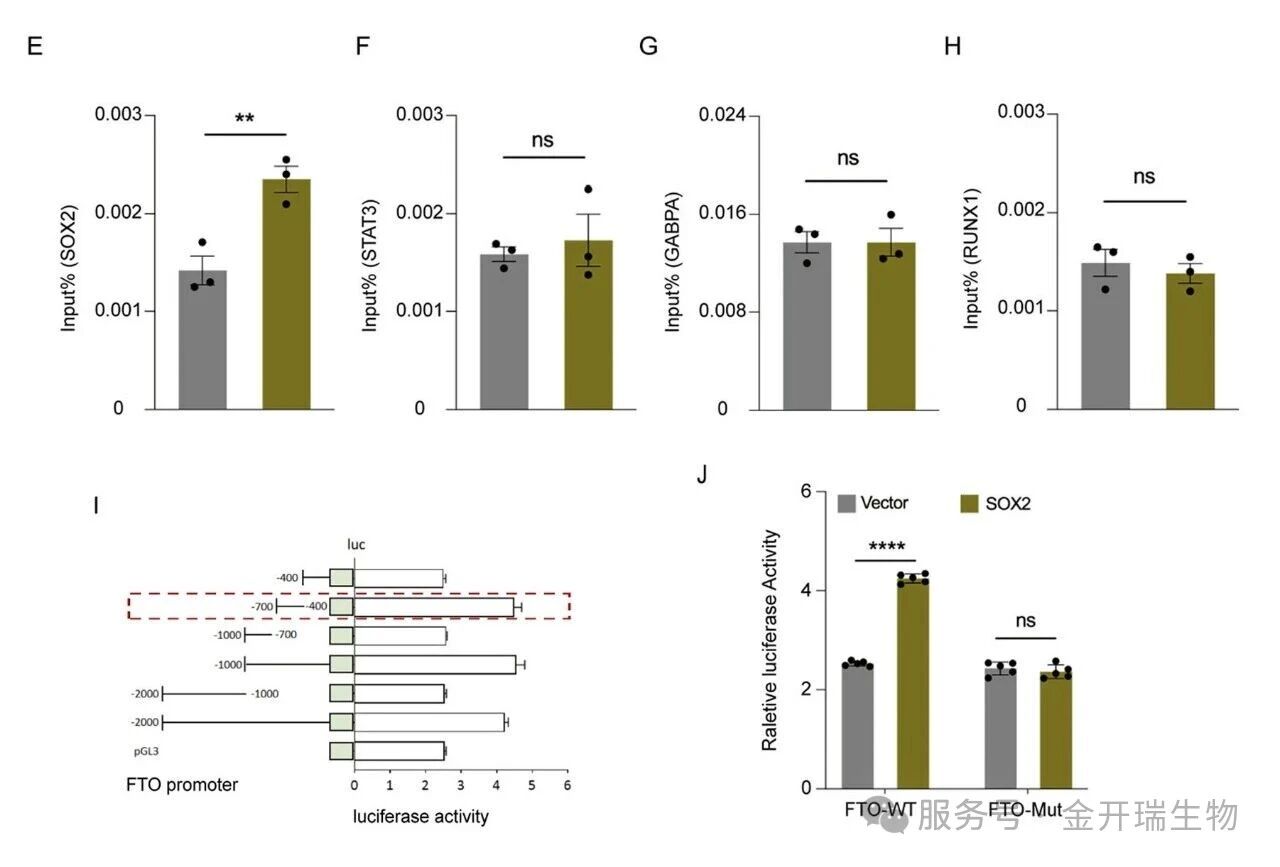
图注:(E-H)SOX 2、STAT 3、GABPA、RUNX 1和FTO双荧光素酶报告定量结果;(I,J)将携带不同截短的纤连蛋白(F-N)启动子的pGL 3-basic载体与pRL-TK共转染入HEK 293 T细胞中。
科学意义:
该实验直接证明了SOX2 作为转录因子直接结合并激活 FTO 启动子,明确了 Mn 通过抑制 SOX2 磷酸化进而下调 FTO 表达的转录层面机制,为理解 Mn 神经毒性的上游调控提供了关键证据。
案例4:揭示膀胱癌化疗耐药新机制

发表时间:2025年7月
期刊:Research (IF=10.7)
研究题目:Combinational Analysis of Metabolomic and O-GlcNAcylation Omics Reveals the HBP Metabolic Regulation of Chemoresistance via GFPT1/NR3C1 O-GlcNAcylation/GPX4 Axis
研究背景:
膀胱癌化疗耐药是临床治疗难点,研究发现NR3C1通过O-GlcNAc修饰增强其转录活性,进而调控下游基因GPX4表达,抑制铁死亡,促进耐药。
双荧光素酶实验设计:
为验证NR3C1是否直接结合GPX4启动子并调控其转录,研究者构建了:野生型GPX4启动子报告载体,突变型GPX4启动子报告载体(突变NR3C1结合位点“GAGACCAGCCTGACCAAC”)
实验结果:
NR3C1过表达显著增强野生型GPX4启动子的荧光素酶活性,突变NR3C1结合位点后,荧光素酶活性显著降低,O-GlcNAcylation位点的突变显著减弱了NR3C1介导的GPX4转录激活。
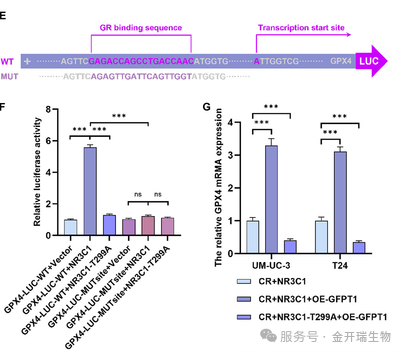
图注:(E) NR3C1在GPX4启动子上的结合序列示意图。(F) 双荧光素酶报告基因检测分析NR3C1在GPX4启动子上的结合位点特异性;检测T299A突变对荧光素酶活性的影响;以GPX4-LUC-WT + Vector组的荧光素酶活性水平为基准进行标准化;采用单因素方差分析及T检验进行统计分析(每组n=4)
科学意义:
该实验直接证实NR3C1通过特异性结合GPX4启动子增强其转录,揭示了O-GlcNAcylation修饰通过增强转录因子活性促进化疗耐药的分子机制。
案例5:揭示心脏移植后心肌缺血再灌注损伤新机制

发表时间:年9月
期刊:Advanced Science(IF:14.1)
研究题目:Inhibition of Macrophage ARID3A Alleviates Myocardial Ischemia-Reperfusion Injury After Heart Transplantation by Reducing THBS1/CD47 Signaling-Mediated Neutrophil Extracellular Traps Formation
研究背景:
心脏移植后,M1型巨噬细胞中ARID3A转录因子上调,可能通过激活THBS1基因表达,进而促进中性粒细胞NETs形成,加重心肌损伤。需验证ARID3A对THBS1的直接转录调控作用。
双荧光素酶实验设计:
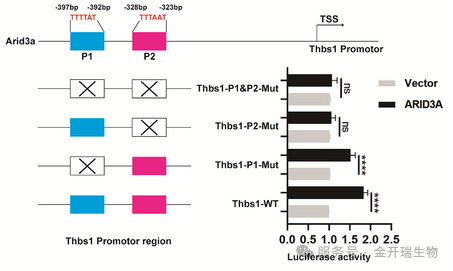
预测与设计:通过JASPAR数据库预测ARID3A在THBS1启动子上的两个潜在结合位点(P1, P2),并据此构建:野生型(WT)THBS1启动子荧光素酶报告载体。单位点(Mut P1, Mut P2)及双位点(Mut P1&P2)突变型报告载体。
功能验证:将上述报告载体与ARID3A过表达载体共转染293T细胞,检测荧光素酶活性变化。
关键结果:
ARID3A过表达可显著激活野生型THBS1启动子。
仅当P2位点突变时,ARID3A的激活作用完全丧失,证明P2是ARID3A的功能性结合位点。
ChIP实验进一步证实ARID3A蛋白直接结合于THBS1启动子的P2区域。
双荧光素酶报告器检测THBS1启动子活性。
科学意义:
该实验直接证实ARID3A通过特异性结合THBS1启动子的P2位点正向调控其转录,从而确立了ARID3A-THBS1轴在驱动巨噬细胞介导心肌损伤中的核心分子机制,为靶向干预提供了关键依据。
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










