传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
缺血性脑卒中(IS)是全球致残致死的主要原因之一,现有治疗手段(如溶栓、取栓)受限于时间窗和血脑屏障(BBB)穿透能力。神经保护剂研发长期面临递送效率低、靶点特异性不足和多重病理机制复杂等挑战。近年来,植物来源的细胞外囊泡样颗粒(P-EVLP)因其天然来源、低免疫原性、高生物相容性、良好的组织穿透性与靶向性,成为新型药物递送系统的研究热点。
最近一项题为“《Houttuynia cordata Thunb-derived extracellular vesicle-like particles alleviate ischemic brain injury by miR159a targeting ACSL4 to suppress ferroptosis》” 的研究揭示了鱼腥草(Houttuynia cordata Thunb)提取的外囊泡样颗粒(HT-EVLP)在治疗缺血性脑损伤中的显著潜力。
一、突破创新
鱼腥草(Houttuynia cordata Thunb.)作为传统清热解毒中药,已知具有抗炎、抗氧化、抗病毒等活性,但其是否通过EVLP形式发挥神经保护作用尚不明确。本研究首次从鱼腥草中提取EVLP(HT-EVLP),并系统探讨其在缺血/再灌注(I/R)脑损伤中的保护作用及分子机制。
本文首次系统阐明了一种传统中药(鱼腥草)通过其天然分泌的细胞外囊泡,携带植物源性miRNA,跨物种靶向调控哺乳动物神经元中的铁死亡关键基因,从而实现对缺血性脑损伤的多机制协同保护。研究在概念、机制、策略、技术四个层面均实现了重要突破,为脑卒中治疗提供了全新的天然纳米治疗策略,也为中药现代化研究开辟了“植物囊泡‑跨物种调控”新方向。
二、关键发现
1、靶向递送与BBB穿透
HT-EVLP能自然靶向缺血区域,穿过血脑屏障,在脑梗死核心区积累。
2、神经功能恢复
在MCAO大鼠模型中,HT-EVLP减少脑梗塞体积,减轻神经元凋亡和铁剥落,促进神经功能恢复。
3、抑制铁死亡
HT-EVLP提高了细胞存活率,并抑制了OGD/R处理的HT22细胞中ACSL4介导的铁死亡。
4、miR159a是关键分子
可能调控铁坏死相关通路,并直接结合ACSL4的3'UTR。miR159a的过度表达降低了Erastin诱导的ACSL4表达,并缓解了HT22细胞中的线粒体损伤。
5、.安全无毒性
体外实验显示,HT-EVLP对正常神经元无毒性,且能显著提升OGD/R模型中的细胞存活率。
这项研究不仅为缺血性脑卒中提供了一种植物来源的新型纳米治疗载体,也为开发基于miRNA的神经保护策略提供了新思路。未来,HT-EVLP有望成为治疗脑缺血再灌注损伤的有效药物或核酸递送系统。
三、主要研究思路
1、HT-EVLP的分离和表征
HT-EVLP的分离与鉴定采用低速梯度离心结合超离心的方法从新鲜鱼腥草中分离出HT-EVLP,经0.22μm滤膜过滤,得到无菌HT-EVLP显示脂质双层和典型的杯状形态,与哺乳动物EV一样,HT-EVLP也表达EV标记蛋白,包括CD9、TSG 101和CD63,HT-EVLP的尺寸范围为100至200 nm,平均粒径为143.8 nm(图1D)。
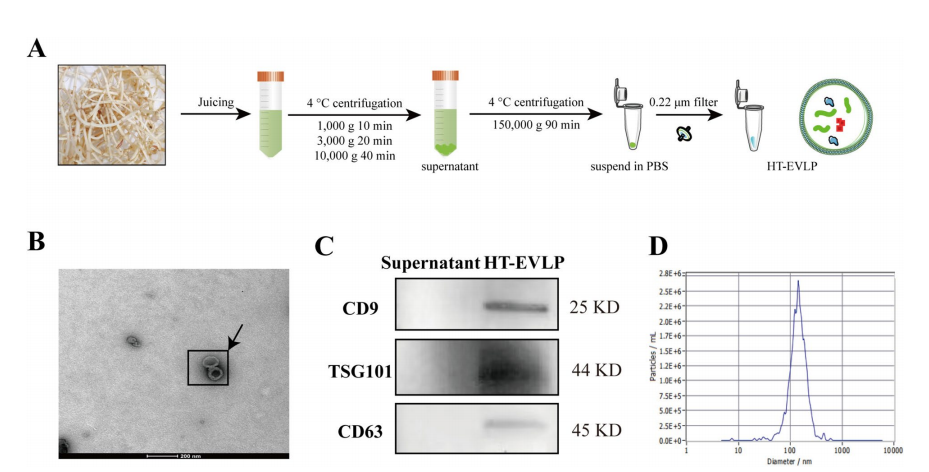
图1.HT-EVLP的分离与表征
2、HT-EVLP改善了I/R大鼠的运动活动并缩小了梗死面积
为了研究HT-EVLP对缺血皮层的天然靶向性,检测了HT-EVLP在MCAO大鼠中的生物分布,使用体内成像系统,结果发现Dil标记的HT-EVLP可以穿过BBB并主要在大脑左侧的梗塞区域中积累(图2A)。HT-EVLP治疗72 h显著改善了MCAO大鼠在旷场试验中的运动活动,证明了运动总距离的增加HT-EVLP处理延长了旋转杆的停留时间并减少了平衡梁的通过时间(图2B-E)。这些行为测试表明HT-EVLP治疗增强了脑I/R损伤大鼠的运动协调能力,并促进了其神经功能恢复。测定脑血流量和脑梗死面积,HT-EVLP可恢复脑血流量(图2F,G)。另外还测试了100 μg/kg HT-EVLP对MCAO大鼠梗死面积的影响,100 μg/ kg HT-EVLP显著减少梗死面积(图2 H,I)。总体而言,HT-EVLP可以减轻I/R引起的脑损伤,促进神经功能恢复。
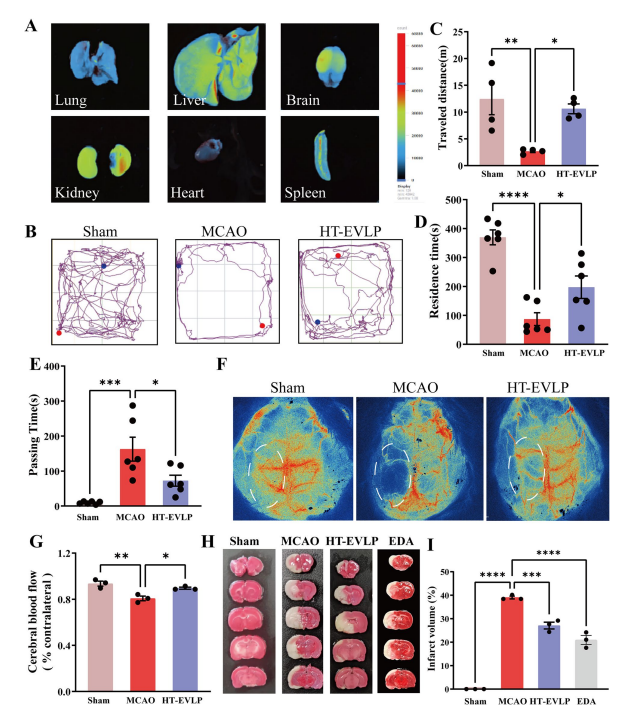
图2. HT-EVLP改善I/R大鼠的运动活动并减少梗塞大小
3、HT-EVLP在大鼠脑部I/R后保护了BBB和神经元损伤
在大鼠脑缺血侧,EB渗漏明显减少,用HT-EVLP,缺血脑的EB定量与以前的结果一致(图3A,B)。缺血性卒中后,细胞外基质的破坏和血管通透性的增加导致脑水肿,脑含水量显著增加。HT-EVLP治疗显著降低了MCAO大鼠的脑含水量(图3C)。然后,进一步证实HT-EVLP治疗消除了MCAO大鼠脑中FITC荧光强度的增加,所有这些结果表明HT-EVLP治疗有效地减少了I/R损伤后的BBB损伤。令人意外的是,作者发现经HT-EVLP处理的MCAO大鼠缺血皮层中TUNEL染色阳性细胞显著减少(图3E、F)。与之相一致的是,MCAO大鼠中NeuN阳性(存活)神经元数量明显降低,而HT-EVLP处理则显著增加了存活神经元的数量(图3G、H)。这些结果提示,HT-EVLP在MCAO后能有效保护神经元免受凋亡,并促进神经元存活,从而凸显其潜在的神经保护效应。
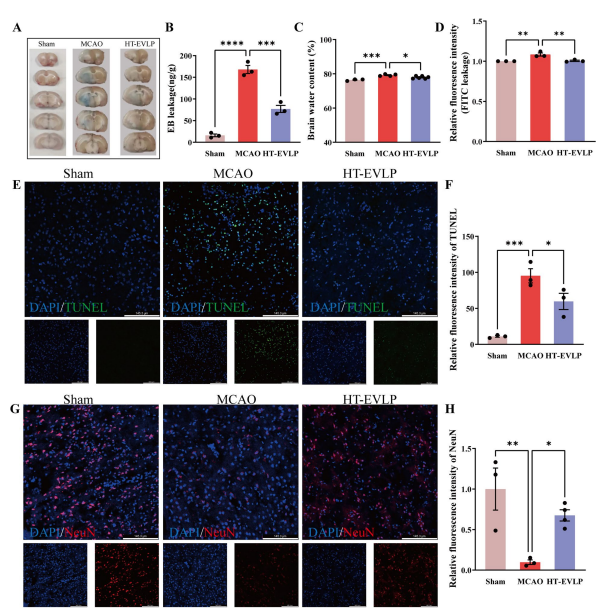
图
4、HT-EVLP预防脑I/R损伤引起的铁凋亡
氧化应激在铁剥落症中尤为重要,铁剥落症由铁依赖性脂质ROS积累驱动,而这与中风有关。通过检测大鼠脑I/R损伤中GSH,SOD,和MDA(脂质过氧化物的分解产物),结果表明脑缺血再灌注后,大鼠脑组织中GSH、SOD含量显著降低,MDA含量显著升高,HT-EVLP治疗可减轻脑缺血再灌注后GSH、SOD含量的降低,脑I/R引起的大鼠大脑皮质MDA含量升高(图4A-C)。上述结果表明HT-EVLP可以通过降低氧化应激来减少大鼠脑I/R损伤。冷冻大鼠脑切片的免疫荧光染色显示MCAO后GPX 4 β/ NeuN β细胞的显著减少。静脉注射HT-EVLP导致GPX 4 β/NeuN β细胞显著增加,(图4D,E)。在大鼠海马中,与假手术组相比,MCAO后GPX 4蛋白水平显著降低,而ACSL 4和TFRC蛋白的水平显著升高。然而,用HT-EVLP治疗通过增加GPX 4水平和降低ACSL 4和TFRC水平有效地逆转了这些变化(图4F-I)。总之,这些结果表明HT-EVLP通过抑制铁凋亡和降低氧化应激而对脑I/R损伤发挥保护作用。
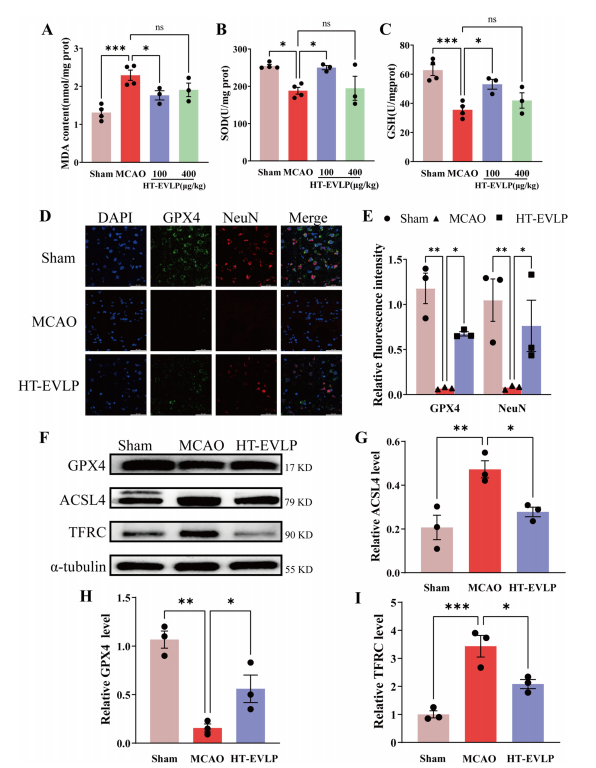
图4. HT-EVLP在大鼠脑缺血后降低铁凋亡水平
5、HT-EVLP保护了HT22细胞中OGD/R诱导的铁凋亡
通过一系列实验系统验证了HT-EVLP在体外对OGD/R诱导的神经元铁死亡的保护作用。实验表明,HT-EVLP在宽浓度范围内对细胞无毒性(图5A),其中10 μg/ml能显著提升细胞存活率,被确定为最佳治疗浓度(图5B-D)。进一步研究发现,HT-EVLP可明显减轻OGD/R导致的线粒体结构损伤,包括肿胀和嵴减少(图5E-G),并能调控铁死亡关键蛋白的表达,即上调GPX4、下调ACSL4和TFRC(图5H-K)。同时,HT-EVLP还能有效抑制脂质过氧化和细胞内二价铁积累(图5N-P)。综上所述,HT-EVLP通过保护线粒体结构、纠正铁死亡相关蛋白表达失衡以及抑制氧化损伤,在体外模型中有效对抗了神经元铁死亡。
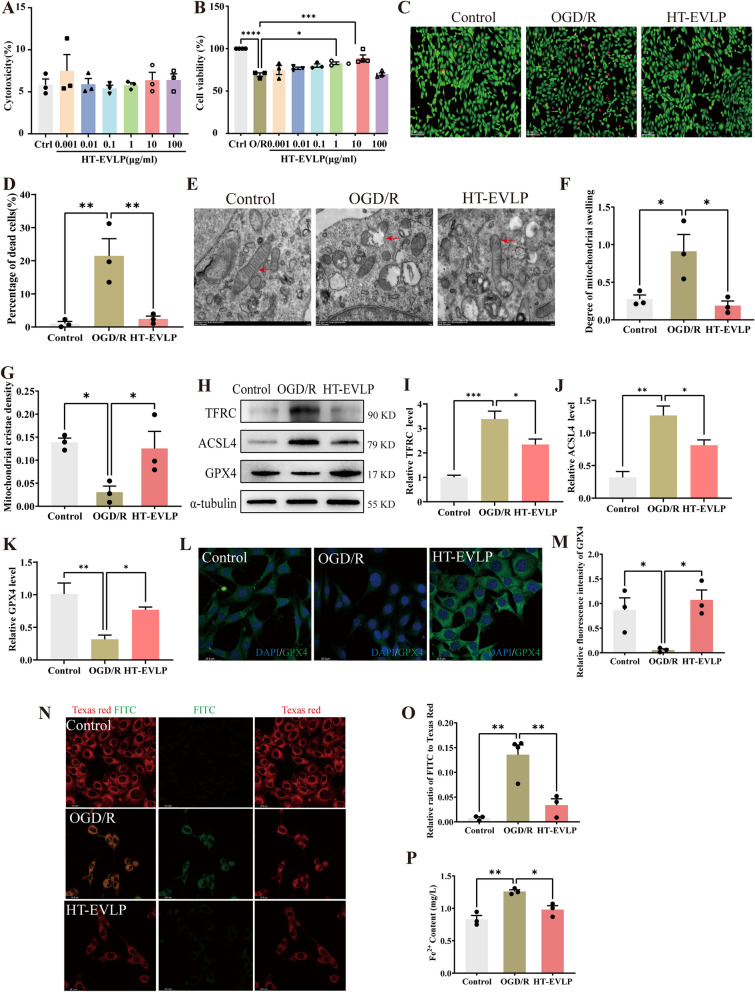
图5. HT-EVLP抑制OGD/R诱导的HT22细胞铁死亡
6、HT-EVLP衍生的miR 159 a特异性降解ACSL 4以抑制铁凋亡
为了精确阐明HT-EVLP在I/R诱导的铁蛋白缺乏症中的神经保护机制,在华盛顿大学遗传学中心进行了对HT-EVLP进行了组成分析,鉴定了25种高丰度存在的miRNA(图6A)。利用生物信息学工具对HT-EVLP来源的miRNAs与靶基因的相互作用进行了预测,并利用TargetScan和Mirnada数据库对植物miRNAs与哺乳动物靶基因的互补配对进行了分析,表明miR 159 a可与ACSL 4的3'非翻译区(UTR)结合GO富集分析表明,miR 159 a参与几种铁凋亡相关过程,包括氧化还原酶活性、亚铁结合、线粒体外膜、铁离子跨膜转运,和离子稳态(图6C,D)。为了验证miR 159 a是否结合ACSL 4的3' UTR,我们进行了双荧光素酶报告测定,确认miR159a显著降低了ACSL4野生型(WT)质粒转染细胞中的萤火虫荧光酶荧光活性。同时,ACSL4突变体(Mut)质粒转染细胞未观察到显著效应,该结果证实了miR 159 a通过与ACSL 4的3 ′-UTR结合来抑制ACSL 4的表达(图6 B,E)。
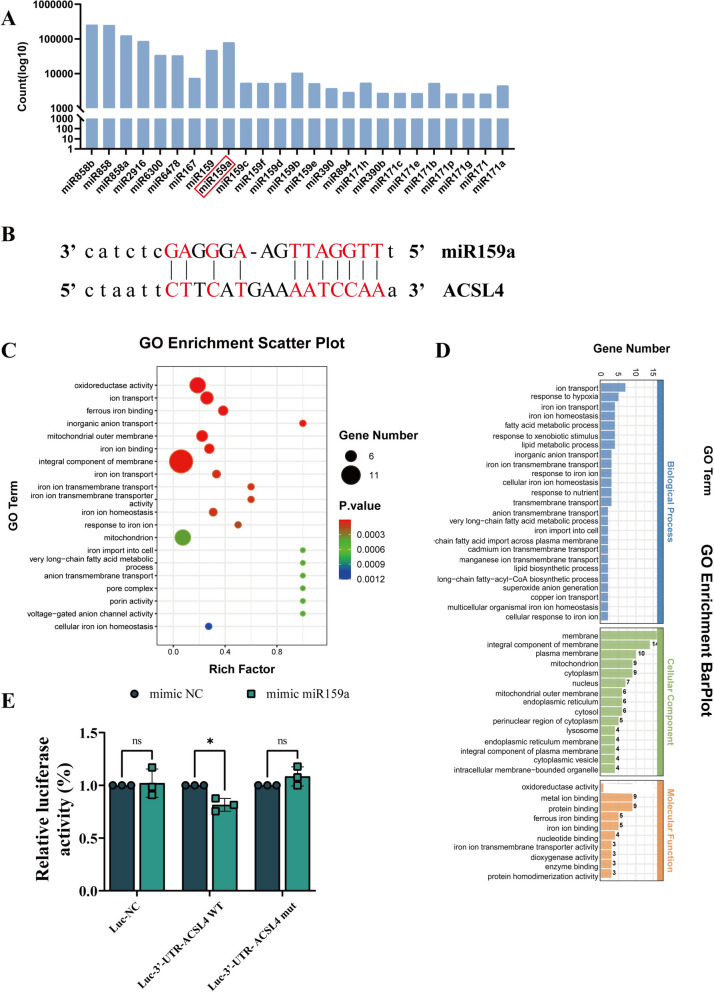
图6. HT-EVLP的小RNA测序结果表明,ACSL4是miR159a的直接靶基因
7、miR159a通过降低ACSL4表达水平抑制Erastin诱导的铁凋亡
接下来,我们成功地将miR 159 a转染到HT 22细胞中(图7 A),通过qRT-PCR验证为了探索HT-EVLP衍生的miR 159 a是否对正常神经元细胞具有细胞毒性,提示miR 159 a对正常神经细胞无细胞毒性(图7 B)。Western blotting检测和免疫荧光染色观察miR 159 a对ACSL 4的影响。5nM miR159a转染后,ACSL4表达水平显著抑制(图7 C,E)。还检测了其他铁凋亡相关蛋白的水平,在Erastin刺激后,GPX 4蛋白水平降低,TFRC蛋白水平升高,这可以通过miR 159 a转染逆转。相反,无义序列(NC)组无显著变化(图7 C,F) ,免疫荧光染色进一步证实了miR 159 a的抗铁凋亡作用,由于Erastin刺激导致ACSL 4显著降低(用红色荧光表示)和脂质过氧化作用增加(由增加的绿色荧光指示),这一现象被miR 159 a转染逆转(图7 G-J)。除此之外miR 159 a转染还减轻了这些线粒体缺陷,恢复了嵴密度并减少了线粒体肿胀(图7 K-M)。这些发现表明miR 159 a可以抑制Erastin诱导神经元HT 22细胞中的铁凋亡,从而通过抑制ACSL 4表达减少神经元损伤。
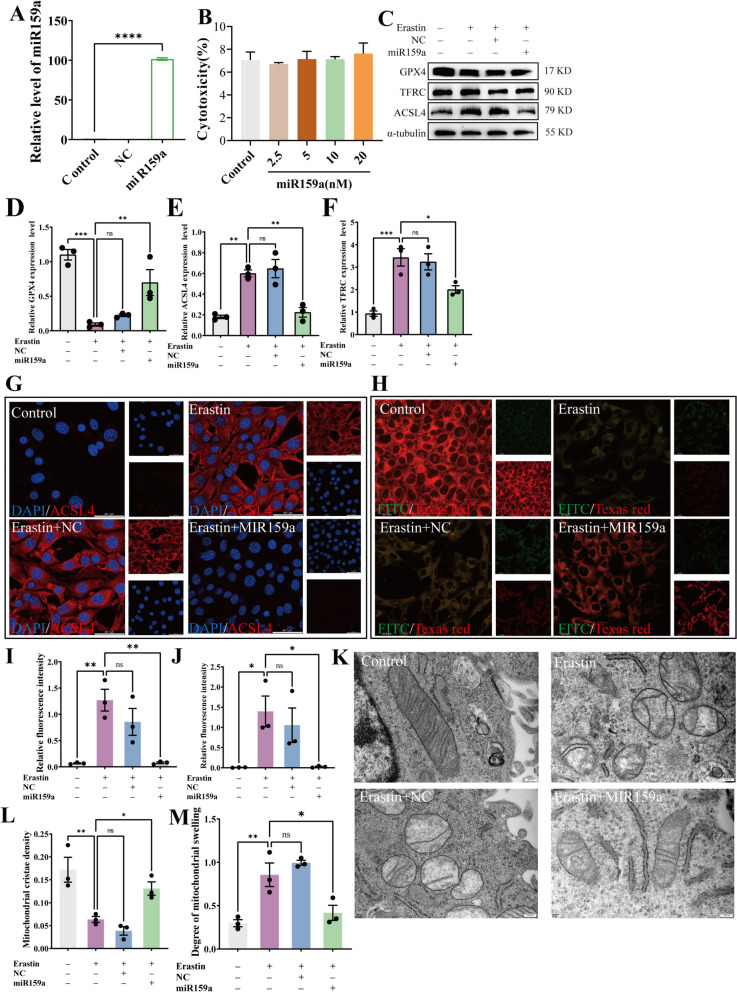
图7. miR159a抑制神经元HT22细胞中Erastin诱导的铁凋亡
四、本研究意义
本研究阐释了“跨界调控”的分子机制:明确了 “植物miRNA → 动物靶基因”的直接调控通路(miR159a靶向ACSL4)。这为“药食同源”植物的保健和治疗作用提供了跨物种基因调控的直接证据,将中药研究从传统的受体-配体相互作用,延伸至表观遗传与转录后调控的更深层次。ACSL4是铁死亡执行的关键分子。本研究不仅再次验证了其在脑缺血中的关键作用,更重要的是,首次发现植物源性的miR159a可作为ACSL4的内源性抑制剂。这为铁死亡调控增添了新的上游调节因子,拓宽了该领域的认知边界。
研究核心机制是HT-EVLP递送miRNA发挥作用。这强有力地证明了植物HT-EVLP可以有效地包裹、运输并递送功能性核酸进入靶细胞。这意味着它们可以作为平台技术,用于装载其他治疗性miRNA、siRNA甚至mRNA,治疗各种大脑疾病,如神经退行性疾病、脑肿瘤等。
该研究为缺血性脑卒中的治疗提供了一种全新的候选策略,更为中药的现代化研究开辟了一条通过“植物囊泡”阐释其系统生物学效应的崭新路径,同时也为天然来源的智能纳米药物递送系统提供了强有力的概念验证。研究有望激发这三个领域后续大量的跟进研究与转化探索。
文献来源:Zhang S, Liang Z, Wu C, Qin Z, Wei X, Liu Y, Su R, Li L, Sun B, Huang L, Wang W, Shen J, Wang G, Qi S. Houttuynia cordata Thunb-derived extracellular vesicle-like particles alleviate ischemic brain injury by miR159a targeting ACSL4 to suppress ferroptosis. Chin Med. 2025 Sep 1;20(1):141.
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










