从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
胰腺癌,尤其是胰腺导管腺癌(PDAC),因其极高的致死率和极低的五年生存率(5%-8%),被称为“癌症之王”。其五年生存率极低且数十年来治疗进展有限,这主要归因于早期诊断困难、对传统放化疗及靶向治疗的高度抵抗。在此背景下,诱导铁死亡——一种由铁依赖的脂质过氧化驱动的新型细胞死亡方式,被视为克服治疗抵抗、特别是凋亡抵抗的极具潜力的新策略。然而,当前铁死亡诱导剂的疗效仍有待提升,亟需发现新的作用靶点和更有效的药物。
近期,南开大学张权教授团队在《Journal of Hematology & Oncology》上发表了一项重要研究,不仅揭示了一个全新的促进胰腺癌进展的分子机制,还从中药雷公藤中成功筛选出能特异性靶向该机制、高效诱导铁死亡的天然化合物——雷公藤红素,这项研究为攻克胰腺癌提供了崭新的靶点、机制和极具前景的候选药物。
1、Sorcin抑制铁死亡并促进了胰腺癌的进展
研究团队首先将目光投向一个名为Sorcin的蛋白质,为评估sorcin功能与癌症进展之间的潜在关系,通过分析大量临床数据,他们发现Sorcin在胰腺癌组织中异常高表达,且表达水平越高,患者生存期越短、肿瘤恶性程度越高。这表明,Sorcin很可能是促进胰腺癌进展的一个关键因子(图1)。
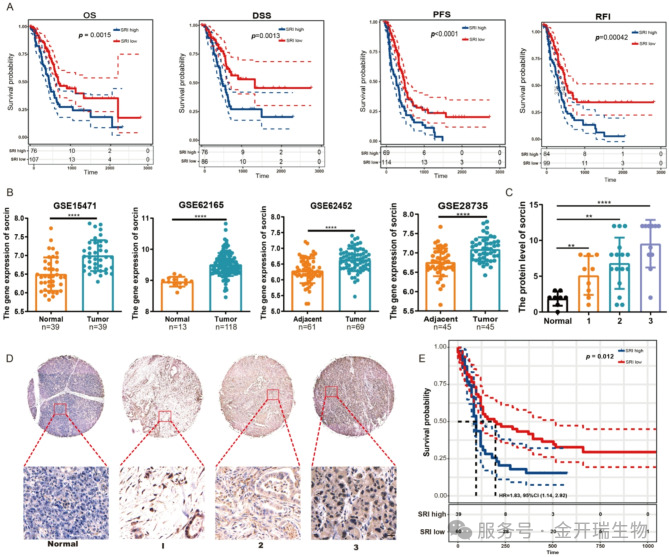
图1. Sorcin在癌组织中表达过多,其过度表达与存活率相关
Sorcin在胰腺癌中的作用尚不明确,进一步的实验证实,Sorcin能够显著抑制胰腺癌细胞的铁死亡。当研究人员敲低癌细胞中的Sorcin后,细胞内的脂质过氧化物(引发铁死亡)大量堆积,典型的铁死亡特征——线粒体嵴的数量减少,线粒体颜色变暗,线粒体皱缩。反之,过表达Sorcin则能保护细胞免于铁死亡(图2)。
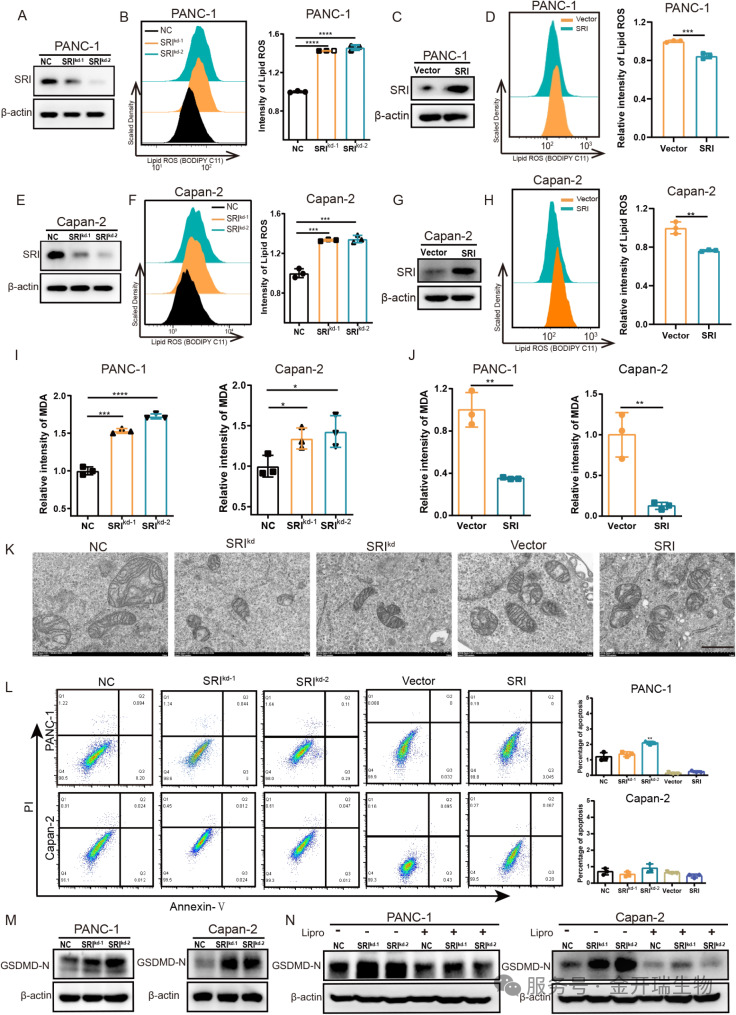
图2. Sorcin被鉴定为铁死亡的抑制剂
2、机制探索
为了揭示 Sorcin 抑制铁死亡的具体机制,研究团队展开了一系列深入探索。
他们发现 Sorcin 并不依赖于其经典的钙离子结合功能,而是通过与转录因子 PAX5 的直接相互作用来发挥作用。为了证明Sorcin是如何发挥保护作用的?研究团队运用蛋白质组学、免疫共沉淀、染色质免疫沉淀、荧光素酶报告系统等多项技术,层层剖析(图3)。
首先,通过免疫共沉淀实验,研究证实了Sorcin与转录因子PAX5在细胞内存在直接的蛋白质-蛋白质相互作用。该结果为Sorcin可能通过结合并调控PAX5的亚细胞定位与功能提供了关键证据。
随后,利用染色质免疫沉淀技术,研究明确了PAX5作为转录因子在基因组上的直接作用靶点。实验结果显示,PAX5特异性结合于FBXL12基因启动子区的两个位点(以位点2为主),从而在分子水平上将上游的Sorcin-PAX5复合物与下游的FBXL12基因转录直接关联。
最后,通过荧光素酶报告基因实验,研究功能性地验证了上述相互作用的生物学后果。实验表明,FBXL12启动子活性依赖于PAX5的结合;当突变其关键结合位点(位点2)后,启动子活性显著丧失。这直接证明了PAX5对FBXL12转录的正向调控作用。
这三个实验共同揭示了一条从Sorcin到PAX5,进而调控FBXL12转录的清晰信号通路,为核心结论提供了坚实的实验基础。
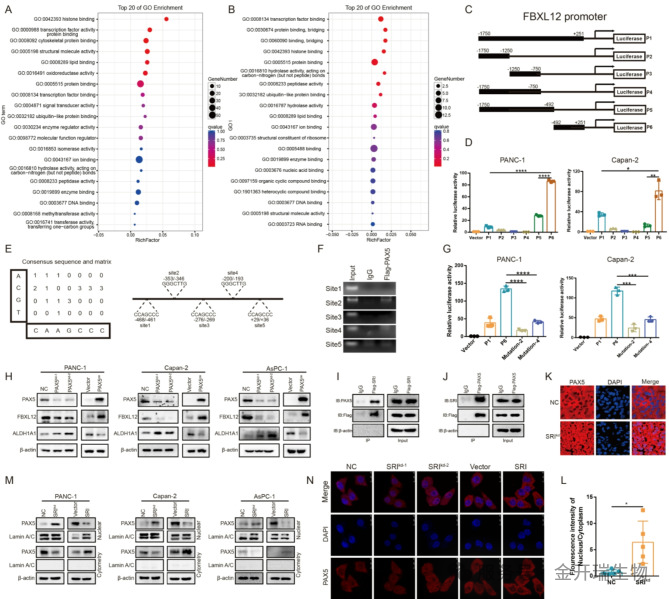
图3. Sorcin介导PAX5的核内易位,以调控FBXL12的转录。
FBXL12 是一种 E3 泛素连接酶,负责给特定蛋白贴上“降解标签”。当 PAX5 被 Sorcin 禁锢在胞质时,FBXL12 的转录受到抑制,其蛋白水平下降。研究进一步发现,FBXL12 的直接作用底物是 ALDH1A1——一个已知的癌症干细胞标志物和抗氧化蛋白,它能清除导致铁死亡的有害醛类物质,从而抵抗铁死亡。
正常情况下,FBXL12 会促进 ALDH1A1 的泛素化降解,但当 Sorcin 高表达导致 FBXL12 减少时,ALDH1A1 得以稳定存在,持续清除脂质过氧化产生的毒性醛类物质,从而保护癌细胞免于铁死亡(图4)。
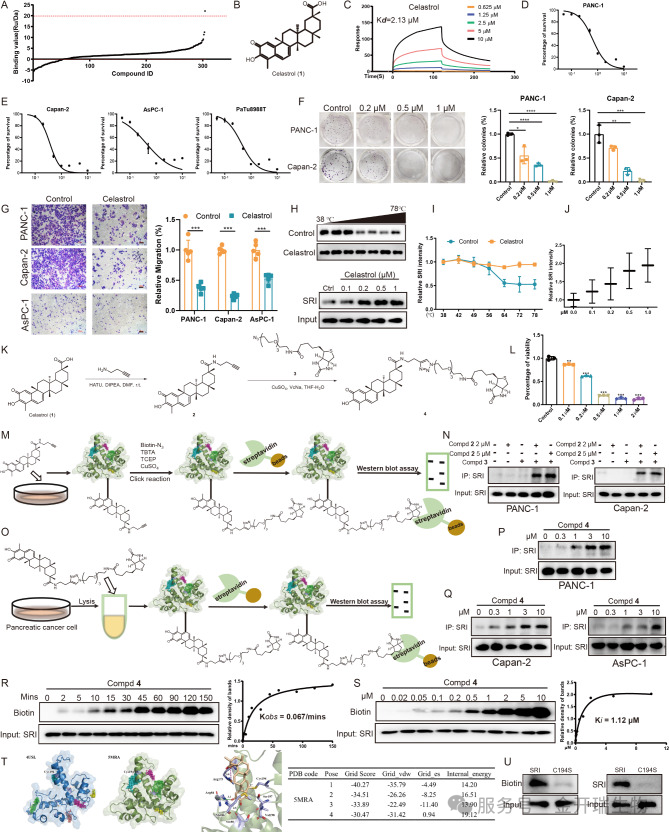
图4. FBXL12介导ALDH1A1泛素化
至此,一条完整的信号通路被清晰地描绘出来:Sorcin高表达 → 结合并抑制 PAX5 核转位 → 下调 FBXL12 转录 → 减少 ALDH1A1 泛素化降解 → ALDH1A1 积累 → 抑制铁死亡→胰腺癌进展。
3、发现药物:从天然产物库中进行筛选
机制明确后,Sorcin本身就成了一个极具潜力的药物靶点。研究团队接下来从包含304种天然化合物的库中,寻找能直接结合并抑制Sorcin功能的小分子。
通过表面等离子共振(SPR)技术进行高通量筛选,雷公藤红素脱颖而出,它与Sorcin蛋白的结合能力最强。后续的细胞功能实验和pull down实验在细胞内外均证实,雷公藤红素能直接且牢固地结合在Sorcin蛋白上(图5A-Q)。
更深入的研究发现,雷公藤红素是通过其活性基团,与Sorcin蛋白第194位的半胱氨酸共价结合,像一把精准的钥匙插入锁孔,改变了Sorcin的结构(图5T-U)。
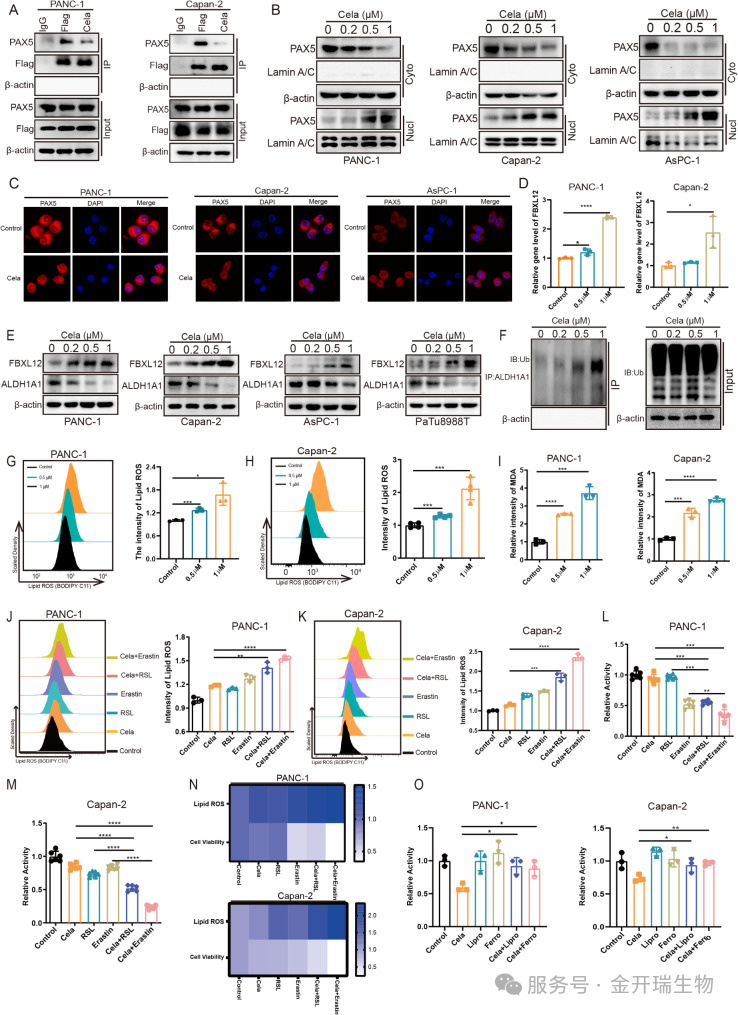
图5. 确认雷公藤红素作为一种与Sorcin蛋白结合的天然产物
4、验证疗效:雷公藤红素重启铁死亡,抑制肿瘤
研究证实,雷公藤红素结合Sorcin后,成功打破了Sorcin与PAX5之间的互作关系。PAX5得以自由进入细胞核,启动FBXL12的大量表达。增多的FBXL12则加速ALDH1A1泛素化,导致其被快速降解。失去了ALDH1A1的保护,胰腺癌细胞内的脂质过氧化失控,铁死亡被重新激活(对应图6)。
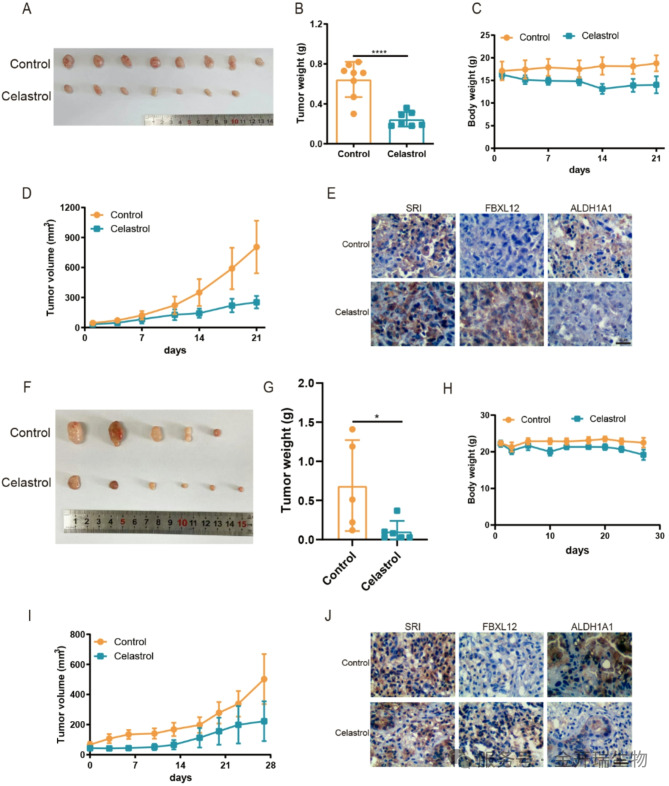
图6. 雷公藤红素通过促进PAX5核易位诱导铁死亡
在动物实验中,无论是细胞移植瘤模型还是更接近临床的患者来源肿瘤模型,雷公藤红素治疗都显著抑制了肿瘤生长,并且肿瘤组织中确实出现了FBXL12上调、ALDH1A1下调的变化(对应图7)。

图7. 雷公藤红素在CDX和PDX小鼠模型中抑制肿瘤生长
5、总结与展望
这项研究完成了一个从临床现象→靶点发现→机制解析→药物筛选→疗效验证的完整闭环。
科学发现:首次揭示了Sorcin通过Sorcin-PAX5-FBXL12-ALDH1A1这条全新通路抑制铁死亡,促进胰腺癌进展。
药物发现:首次发现雷公藤红素是Sorcin的直接抑制剂,通过共价结合破坏其功能,从而激活上述通路,诱导铁死亡。
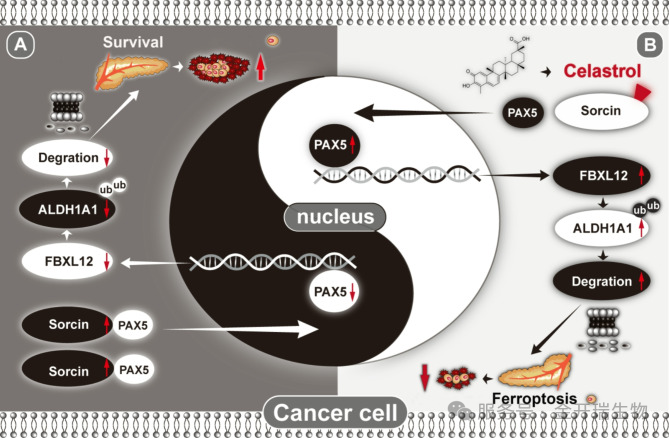
图8. 机制模型示意图:高表达sorcin抑制铁死亡及雷公藤红素诱导胰腺癌细胞铁死亡
该研究不仅为理解胰腺癌的耐药和进展提供了新视角,更重要的是,将Sorcin确立为一个“可成药”的新靶点,并将雷公藤红素及其衍生物推举为开发胰腺癌新型铁死亡诱导剂的领先化合物。尽管雷公藤红素本身可能存在毒性等问题,但其作为“先导分子”,为后续设计更安全、更有效的靶向Sorcin的抗癌药物指明了方向,这为最终攻克“癌症之王”带来了新的希望。
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










