REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
下肢严重缺血(Critical Limb Ischemia, CLI)是糖尿病、动脉粥样硬化等疾病的严重并发症,常导致顽固性疼痛、组织坏死、难以愈合的溃疡,最终可能面临截肢风险。红景天(Rhodiola rosea)作为一种传统药用植物,已被证实具有抗缺氧、抗氧化、抗炎和心血管保护等多种药理活性。然而,其新鲜根茎来源的外泌体样囊泡(RhELNs)的生物学功能,尤其是在缺血性疾病治疗中的应用与机制,尚属空白。 近期,发表于《Regenerative Biomaterials》期刊上一篇题为“Rhodiola rosea-derived exosome-like nanovesicles inhibit vascular endothelial pyroptosis in the treatment of limb skeletal muscle ischemic injury through the TXNIP/NLNP3 pathway”的研究填补了这一空白。该研究从传统高原药用植物—红景天(Rhodiola rosea)中成功分离出其根茎来源的外泌体样纳米囊泡(RhELNs),并系统阐明其在治疗下肢缺血性损伤中的显著疗效与分子机制。不仅解析了RhELNs的代谢物组成,还鉴定出一种新型功能分子 novel-miRNA-115-5p,进一步通过体内外实验证实其通过抑制 TXNIP/NLRP3 通路减轻血管内皮细胞焦亡、保护线粒体功能,从而促进血管再生与组织修复。该工作为植物源性中药的现代化、纳米化研究提供了新的实验依据与治疗思路。
一、主要研究成果
本研究取得了以下几项核心发现:
➤成功提取并表征了红景天来源的RhELNs,其具备典型的囊泡形态、合适粒径和良好稳定性,并能被血管内皮细胞高效摄取。
➤体外实验证明,RhELNs能显著促进缺氧条件下血管内皮细胞(HAECs)的增殖、迁移和血管形成能力,并抑制其凋亡。
➤体内动物模型表明,尾静脉注射RhELNs能有效改善缺血下肢的血流灌注、减轻骨骼肌萎缩和纤维化、降低局部炎症水平,并促进新生血管生成。
➤机制上首次揭示:RhELNs中富含一种新型微小RNA(novel-miRNA-115-5p),该miRNA通过靶向TXNIP保护血管内皮细胞免受线粒体损伤,并通过抑制TXNIP-NLRP3通路,在缺氧条件下减少细胞焦亡,从而促进血管再生。
二、主要研究思路
1、RhELNs的提取与表征
研究首先建立了从新鲜红景天根茎中提取ELNs的标准流程(差速离心结合蔗糖密度梯度离心)。透射电镜(图1B)显示提取物为典型的杯状囊泡结构;粒径分析(图1C)表明其主峰在30-200 nm之间,符合外泌体特征;Zeta电位(图1D)约为-11.1 mV,表明体系稳定性良好。关键的是,用荧光染料DIR标记的RhELNs与内皮细胞共孵育后,通过共聚焦显微镜(图1E)观察到清晰的时间依赖性细胞内化,证明其能被靶细胞有效摄取,是发挥功能的先决条件。
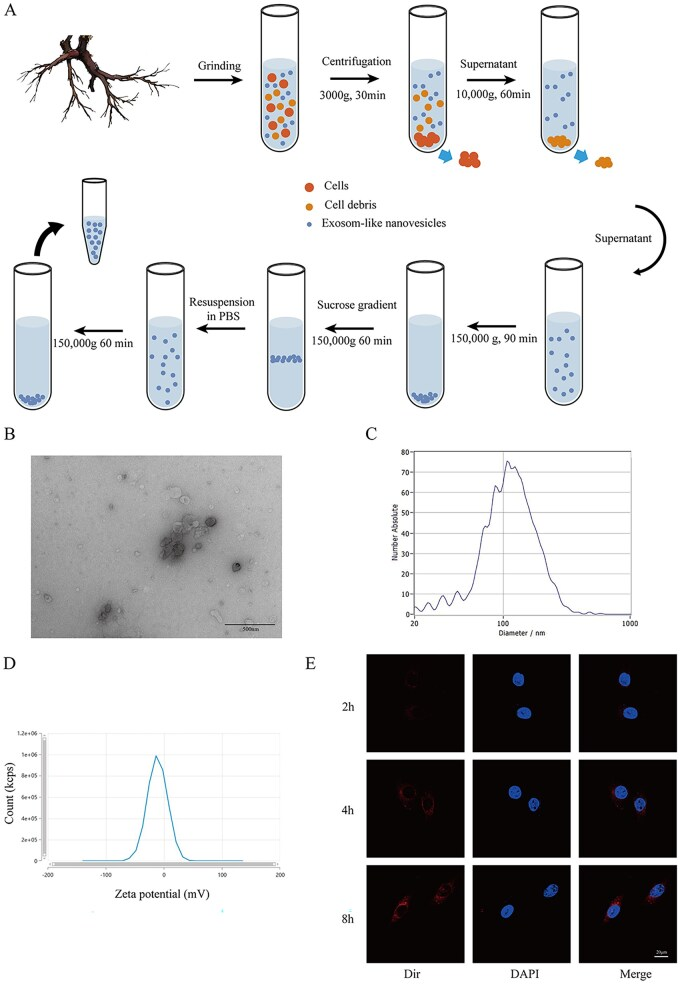
图1.RhELNs的提取与表征
2、RhELNs在体外促进内皮细胞修复
在构建的细胞缺氧模型中,研究者通过一系列功能实验验证了RhELNs的疗效:
5-乙炔基-2’-脱氧尿苷(EdU)检测显示RhELNs处理后缺氧条件下细胞数量随剂量依赖性增加(图2A, B)。
Transwell与划痕实验证明RhELNs能显著增强细胞的迁移能力(图2C-F),这对于血管新生至关重要。
TUNELRhELNs在缺氧条件下减轻了HAEC中的凋亡,且随着RhELN浓度增加,其抗凋亡能力增强(图2G, H)。
这些结果表明RhELNs促进血管内皮细胞的增殖、迁移和侵入,同时减轻体外缺氧诱导的凋亡。
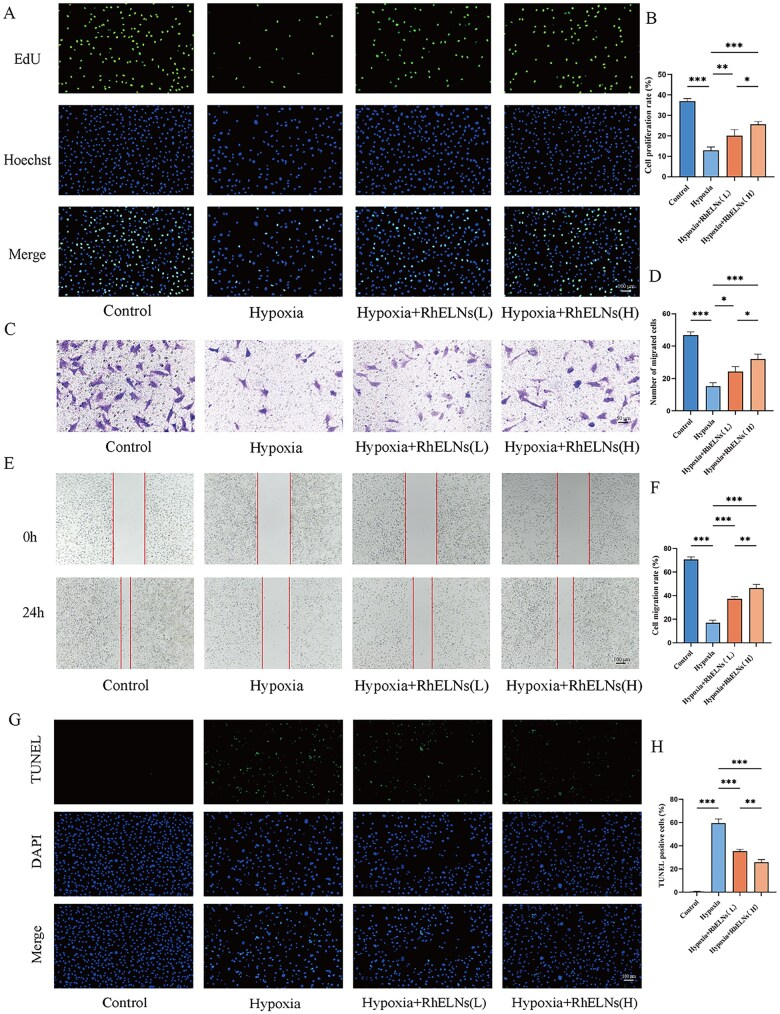
图2.RhELNs对缺氧下HAEC修复的影响
3、体内验证(小鼠下肢缺血模型)
(1)RhELNs可以降低炎症水平,促进缺血性骨骼肌的组织修复
为评估RhELNs修复下肢缺血的潜力,建立了后肢缺血模型。实验组包括Sham组、RhELNs组(假手术后尾静脉注射RhELNs组)、缺血组(股动脉结扎)和Ischemia+RhELNs组(股动脉结扎后注射RhELNs)。
组织学改善:HE染色(图3A)显示RhELNs治疗后与缺血组相比骨骼肌内炎症细胞浸润显著减少;Masson染色(图3B-E)显示RhELNs治疗后骨骼肌纤维化显著减轻;肌肉横截面积分析(图3F)表明小鼠肢体缺血引起的肌肉萎缩明显缓解。
炎症因子下降:ELISA检测(图3G, H)发现RhELNs有效降低缺血后肌肉组织中促炎细胞因子IL-6和TNF-α的水平。
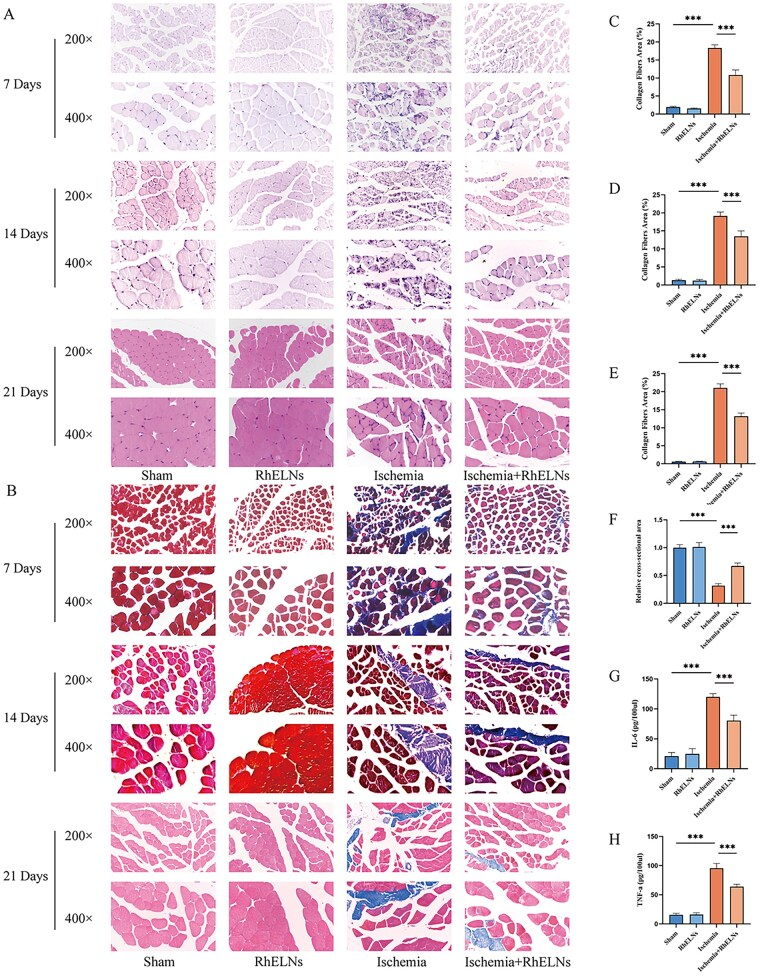
图3.下肢骨骼肌缺血模型中RhELNs治疗后骨骼肌的组织学和细胞因子变化
(2)RhELNs可以促进下肢骨骼肌缺血模型中的血液灌注和血管生成
术后14天,宏观照片(图4A, C)和缺血评分(图4B)显示肢体坏死和萎缩改善;普勒血流仪检测显示,在术后第7、14和21天,以血流正常的对侧肢体为参照,RhELNs治疗组小鼠的灌注比均高于未治疗组(图4D和E);第14天对肌肉组织的免疫荧光分析显示,RhELNs治疗的缺血肢体CD31和α-SMA表达显著增加,较未治疗缺血组显著增加,表明RhELNs治疗后新生血管形成能力增强(图4F–H)。这些结果表明,RhELNs不仅能减少缺血部位的炎症和纤维化,还能促进血管的形成和成熟。总体而言,结果表明RhELNs在促进下肢缺血修复和恢复方面发挥关键作用,通过增强血管再生和减轻缺血相关组织损伤。
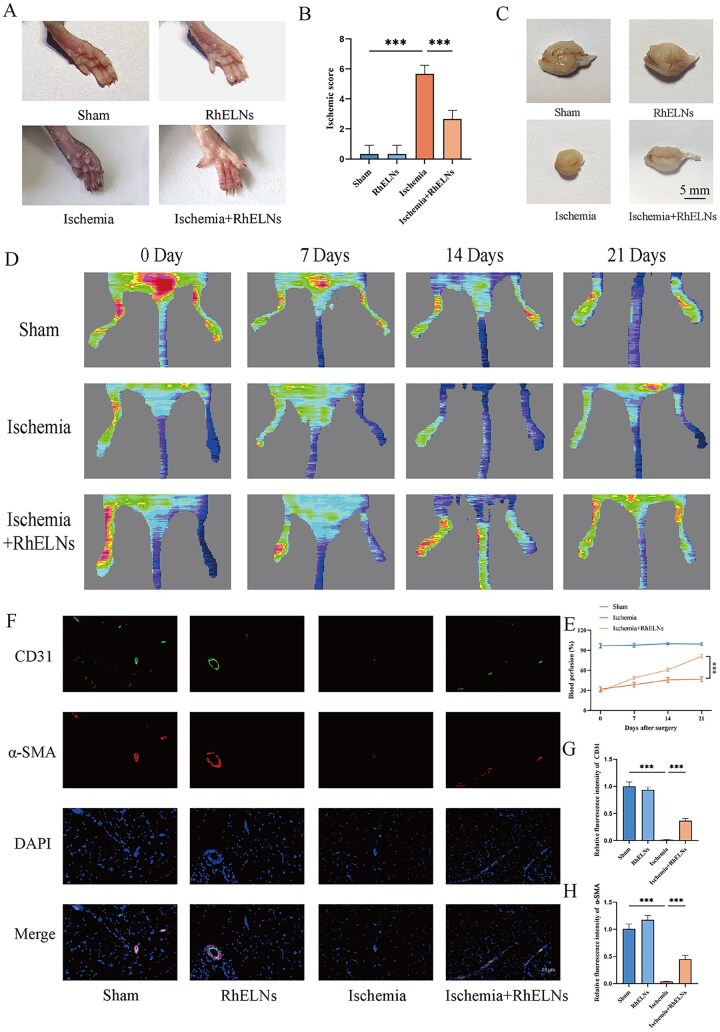
图4. RhELNs对下肢骨骼肌缺血模型中灌注和血管生成的影响
4、分子机制深入解析
(1)发现关键分子
通过测序在RhELNs中发现novel-miRNA-115-5p。生物信息学预测及双荧光素酶报告基因实验(图5C, D)证实其能直接靶向结合并抑制TXNIP的mRNA。Western blot(图5A, B, E, F)验证了RhELNs或该miRNA模拟物均可降低缺氧内皮细胞中TXNIP蛋白水平。
功能验证:在缺氧细胞中,转染该miRNA的模拟物(Mimics)可再现RhELNs的促增殖(Edu,图5G, H)、促迁移(Transwell,图5I, J)和促血管形成(图5K, L)作用;而其抑制剂(Inhibitor)则抵消RhELNs的保护效应。
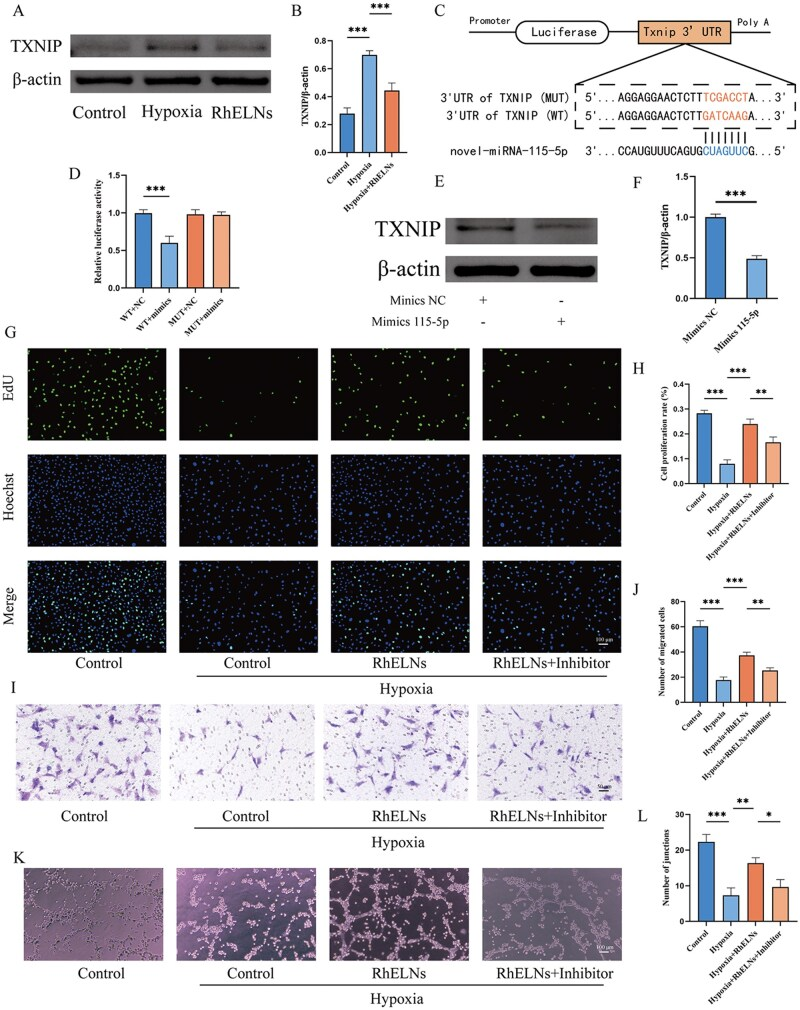
图5.通过新型miRNA-115-5p调控RhELNs中TXNIP表达
(2)阐明下游通路
TXNIP是激活NLRP3炎症小体的关键蛋白。Western blot显示,转染新型miRNA-115-5p模拟物可降低缺氧诱导的细胞焦亡相关关键蛋白(包括NLRP3、GSDMD-NT、切割型caspase-1和IL-1β)的升高水平(图6A–E),同时,通过比较新型miRNA-115-5p与模拟物阴性对照对细胞焦亡的抑制作用,以及过表达TXNIP,我们进一步验证了新型miRNA-115-5p/TXNIP轴在调控血管内皮细胞死亡中的作用(图6F–L)。这些结果凸显了新型miRNA-115-5p/TXNIP轴在调节血管内皮细胞对缺氧应激反应(包括增殖、迁移和细胞焦亡)中的作用。此外,在动物水平上使用新型miRNA-115-5p治疗下肢缺血小鼠,并通过蛋白质印迹实验证明,新型miRNA-115-5p可通过缓解NLRP3介导的细胞焦亡通路修复下肢骨骼肌缺血损伤。

图6. 通过新型miRNA-115-5p/TXNIP轴调控血管内皮细胞的缓释
(3)延伸至线粒体保护
TXNIP也参与调控线粒体氧化应激,实验发现新型miRNA-115-5p模拟物处理可降低mtROS的产生(图7A和B)、抑制细胞ROS积累(图7C和D)、减少mPTP开放程度(图7E和F)并提升MMP的稳定性(图7G-I)。当过表达TXNIP时,新型miRNA-115-5p模拟物的有益效应被逆转,这证实了新型miRNA-115-5p通过靶向TXNIP,在缺氧条件下保护细胞免受线粒体损伤。
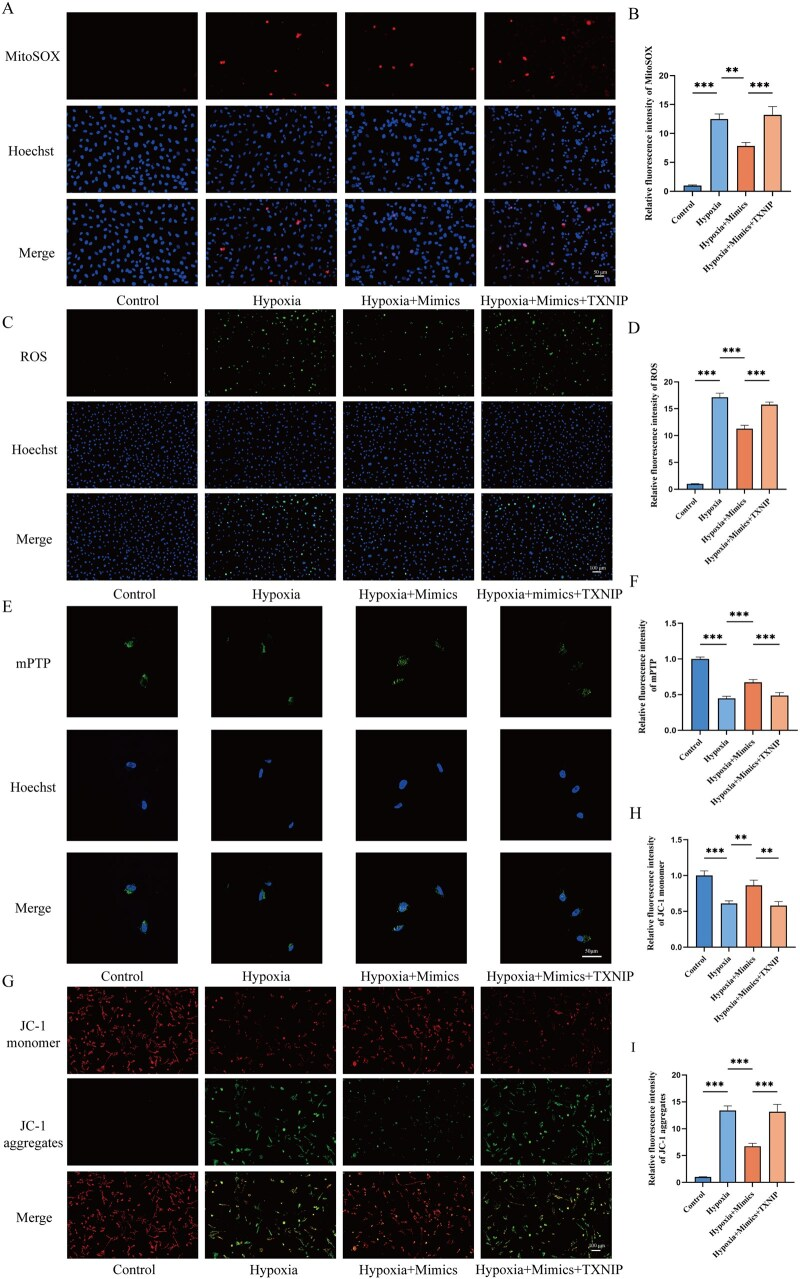
图7. 新型miRNA-115-5p/TXNIP轴对血管内皮细胞线粒体损伤的影响
总结
本研究系统性地论证了红景天来源外泌体样纳米囊泡(RhELNs) 作为一种新型植物药物治疗下肢缺血性损伤的有效性与科学性。其创新性在于:首次鉴定出RhELNs中的关键效应分子novel-miRNA-115-5p,并完整阐明了其通过靶向TXNIP,进而抑制NLRP3介导的血管内皮焦亡并保护线粒体功能的全新作用通路(miRNA-115-5p/TXNIP/NLRP3轴)。
这项研究不仅为下肢缺血的治疗提供了极具前景的候选生物制剂,也为理解植物外泌体跨物种调控哺乳动物细胞命运的机制提供了重要范例。
局限性:
如主要聚焦于血管内皮细胞,而对巨噬细胞等在缺血修复中扮演重要角色的免疫细胞关注不足。未来研究可进一步拓展RhELNs对其他靶细胞的作用,并推动其向临床转化的药代动力学和制剂学研究。
总之,该工作是一次从传统药用植物到现代纳米治疗剂的成功探索,体现了“中西医结合”与“交叉学科研究” 在解决重大临床问题中的强大潜力。
文献来源:Liu D, Zhang Z, Wang Y, Liang X, Chang Y, Wang C, Guo Y, Zhang S, Zhou J, Zhang M, Shen H, Zhang X, Gao W. Rhodiola rosea-derived exosome-like nanovesicles inhibit vascular endothelial pyroptosis in the treatment of limb skeletal muscle ischemic injury through the TXNIP/NLNP3 pathway. Regen Biomater. 2025 Oct 31;12:rbaf113.
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










