IF=15+重庆医科大学陈教授课题组发现circSEPT9可作为TNBC潜在的生物标志物和治疗靶点
信息来源:金开瑞 作者:genecreate 发布时间:2020-07-23 13:02:12
题目:The circRNA circSEPT9 mediated by E2F1 and EIF4A3 facilitates the carcinogenesis and development of triple-negative breast cancer
期刊名称:Mol. Cancer
影响因子:15.302
主要技术:RNA pull down、双荧光素酶、RIP、ChIP
研究背景
越来越多的研究表明,circRNA与许多癌症的发生发展密切相关。然而,环状RNA在三体阴性乳腺癌(TNBC)中的生物学功能和潜在的分子机制仍不清楚。作者运用高通量RNA测序技术研究了circRNA在四对三阴性乳腺癌及癌旁组织中的表达模式,并通过qPCR和原位杂交技术评估circSEPT9的表达和预后意义,并进行了一系列的体内和体外功能检测实验,以研究circSEPT9在三阴性乳腺癌变及发展过程中的调控作用。同时采用Chip、双荧光素酶报告基因及RIP等检测方法探讨了E2F1和EIF4A3对circSEPT9的潜在调控作用,验证了circSEPT9和mir-637的互作关系。
技术路线
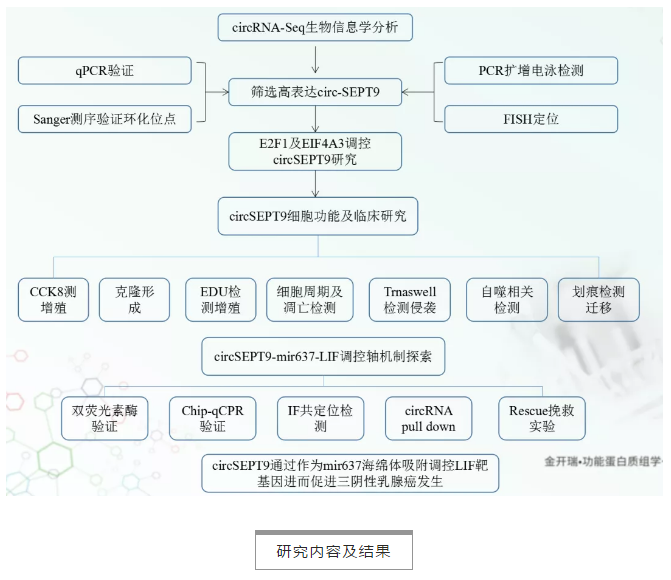
研究内容及结果
1. circRNA测序及生物信息学分析筛选circSEPT9
4对三阴性乳腺癌及癌旁组织,通过circRNA二代测序,根据生物信息学分析发现354个差异表达circRNAs,其中上调circRNA 47个,下调circRNA 354个(筛选条件:fold_change≥2,P-value值<0.05)。作者从TOP30个差异表达circRNA中又进一步筛选到一个novel circRNA,circSEPT9(hsa_circ_0005320,由SEPT9第二号外显子反向剪切形成)作为项目研究重点(Fig. 1a)。针对circSEPT,作者从以下几个方面层层进行验证:
(1). qPCR检测验证其在三阴性乳腺癌中表达上调
(2). sanger 测序法验证circSEPT环化位点(Fig.1b)
(3). 分别设计divergent引物及convergent引物,以cDNA及gDNA为模板分别进行扩增检测,验证其确实为环状RNA(Fig.1c)
(4). 通过扩增及电泳检测发现circSEPT9相比于线性SRPT9对RNase R消化的抵抗能力更高(Fig. 1d&e)
(5). 使用放线菌素D抑制剂评估circSEPT9的稳定性(Fig. 1f)
(6). FISH实验对circSEPT9进行定位,主要分布于细胞质中(Fig1g&h)
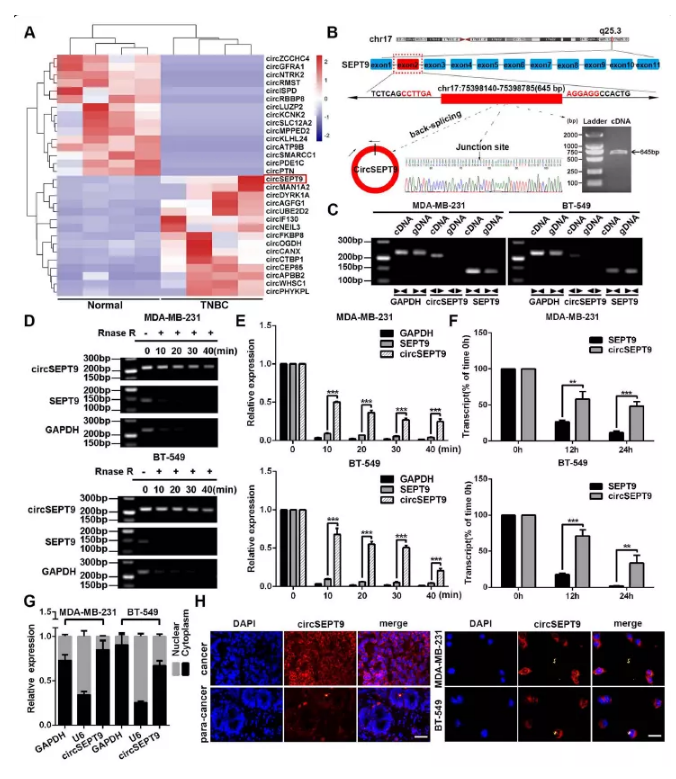
图1 三阴性乳腺癌细胞中circSEPT9的验证及检测
A. 4对三阴性乳腺癌及癌旁样品top15差异circRNA聚类热图,红色代表上调,蓝色代表下调
B. sanger测序验证环化位点及qPCR检测表达量
C. 以cDNA及gDNA进行扩增及凝胶电泳检测
D&E. 以RNase R处理三阴性乳腺癌细胞并通过PCR扩增检测其表达量情况
F. 放线菌素D处理12及24h后,通过qPCR检测三阴性乳腺癌细胞中circSEPT9和线性SEPT9的表达
G. 核质分离检测circSEPT9表达,以GAPDH作为质对照,U6作为核对照
H. FISH检测实验观察circSEPT9定位,分别以组织及细胞进行染色拍照,细胞核采用DAPI染色
2. E2F1和EIF4A3促进circSEPT9的表达
E2F1是E2F转录因子家族成员,可在转录水平调控靶基因的表达。作者通过生物信息学网站预测(http://jaspar.genereg.net)发现SEPT9启动子上有13个与E2F1结合的位点,作者从中选择了3个最接近的结合位点,通过双荧光素酶素酶及chip-qPCR进行验证。为探索E2F1和EIF4A3对circSEPT9表达的影响,分别构建过表达质粒,同时合成干扰siRNA,转染三阴性乳腺癌细胞进行过表达及干扰效果检测,后进行qPCR检测circSEPT9表达变化。
实验结果如下:
(1). 筛选验证有效的过表达质粒及干扰siRNA分别转染三阴性乳腺癌细胞MDA-MB-231及BT-549细胞后,qPCR检测SEPT9表达,结果显示:E2F1促进SEPT9的表达(Fig. 2a)
(2). 通过构建野生型及突变型载体,通过双荧光素酶实验检测生信预测SEPT9启动子结合位点,结果显示:所筛选2号及3号预测结合位置与E2F1结合,1号不结合(Fig. 2b&c)
(3). 利用E2F1对应Chip级别抗体进行染色质免疫共沉淀实验,实验获取互作DNA产物进行Chip-qPCR实验分析结果表明:E2F1可以结合SEPT9基因启动子区并加速其转录活性(Fig2d)
小结:以上部分数据证明SEPT9是转录因子E2F1的靶基因。
EIF4A3是外显子连接复合体的核心组成部分,在mRNA前期剪接中起着至关重要的作用。作者接下来又从circSEPT9的上游和下游区域找到5个与EIF4A3结合位点,并通过RIP实验验证其互作位点信息。同时在过表达及干扰EIF4A3后qPCR检测circSEPT9表达水平变化。作者进一步通过敲低circSEPT9后检测三阴性乳腺癌细胞中细胞周期相关蛋白的表达变化,并通过挽救实验共转过表达质粒后再次检测circSEPT9表达变化,实验结果如下:
(1). E2F1过表达及干扰siRNA分别转染MDA-MB-231及BT-549细胞后,qPCR检测circSEPT9表达量变化,结果显示:E2F1上调显著促进了circSEPT9的表达,干扰E2F1表达后抑制circSEPT9的表达(Fig.2e)
(2). RIP分析结果显示:EIF4A3可以通过推定的结合位点与SEPT9 pre-mRNA结合(Fig. 2g)
(3). qPCR结果显示:过表达EIF4A3促进circSEPT9的表达,干扰EIF4A3后抑制circSEPT9表达(Fig. 2h)
(4). 干扰circSEPT9后,细胞周期相关蛋白表达下降(Fig.2i)
小结:以上数据显示EIF4A3通过促进circSEPT9的表达进而调节细胞周期相关蛋白的表达。
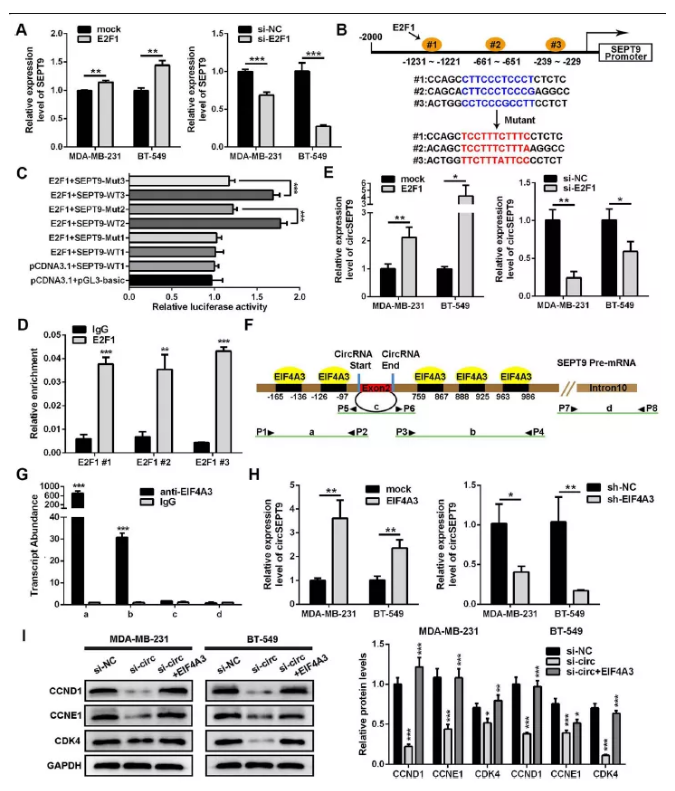
图2 E2F1和EIF4A3分别与SEPT9启动子和pre-mRNA结合增强circSEPT9的表达
(A) qPCR检测过表达及干扰E2F1后三阴性乳腺癌细胞中SEPT9表达变化。
(B) 生物信息学预测并选定的SEPT9启动子上E2F1 3个结合位点,其中包括野生型(WT)及突变型(Mut)序列。
(C) 双荧光素酶检测SEPT9与E2F1对应3个结合位点。
(D) 在MDA-MB-231细胞中进行Chip-qPCR检测验证结合位点
(E) E2F1过表达及干扰siRNA转染三阴性乳腺癌细胞后qPCR检测circSEPT9表达变化
(F&G)RIP实验证实EIF4A3可以与SEPT9 pre-mRNA结合
(H)过表达及干扰EIF4A3后,qPCR检测circSEPT9表达
(I)WB检测细胞周期相关蛋白表达及灰度值统计(*P<0.05,**P<0.01,***P<0.001)
3. 细胞及临床研究证实circSEPT9高表达
临床收集60对三阴性乳腺癌及癌旁组织样品,同时在三阴性乳腺癌细胞MDA-MB-231、BT-549、MDA-MB-453、MDA-MB-468及正常乳腺上皮细胞MCF-10A中进行qPCR检测circSEPT9表达,结果显示circSEPT9在三阴性乳腺癌细胞及组织中的表达均高于正常乳腺上皮细胞及癌旁组织,与RNA-Seq结果保持一致(Fig. 3a&b)。作者进一步绘制ROS曲线用于评估circSEPT9对三阴性乳腺癌筛查的诊断价值,结果显示:circSEPT9的曲线下面积(AUC)为0.711,在截距为1.971时,特异性和敏感性分别为75%和63.3%(Fig. 3c)。Kaplan-Meier生存分析结果显示:乳腺癌患者中circSEPT9高表达(P=0.001)。N2-3阶段(P=0.001)和TNM II/III期(P=0.031)总体生存率低于N0-1期和TNM I期(Fig. 3g),预示着circSEPT9可以作为肿瘤标记物,高表达circSEPT9造成患者的不良预后。
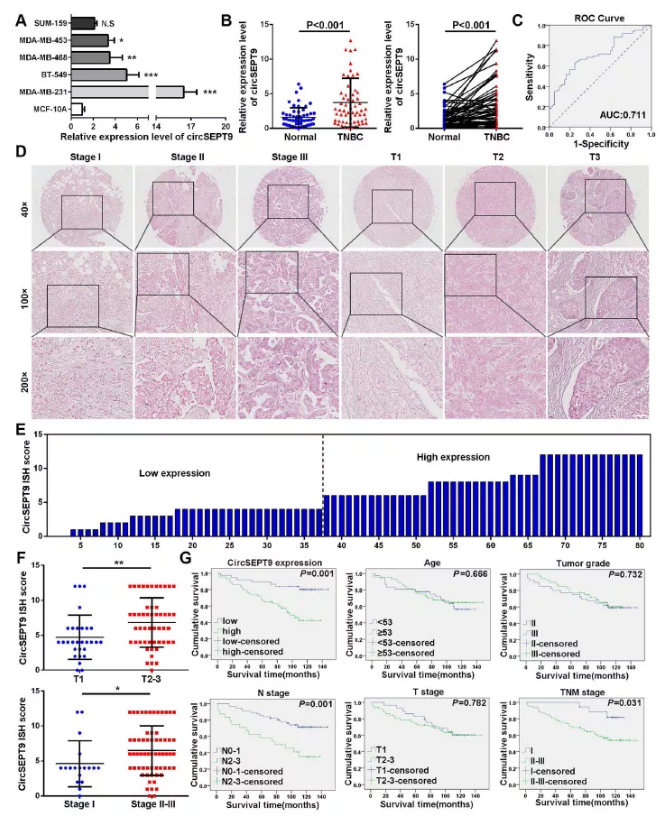
图3 circSEPT9在三阴性乳腺癌患者中高表达并与患者不良预后有关
(A和B) qPCR检测60对临床三阴性乳腺癌及癌旁样品及三阴性乳腺癌细胞及正常乳腺上皮细胞中circSEPT9表达
(C)ROC曲线评估
(D)原位杂交检测circSEPT9在80个乳腺癌组织中的表达(比例尺,50um)
(E)在80个TNBC组织中计算ISH染色分数,ISH染色得分<6被定义为低表达,≥6视为高表达
(F)在80例不同的三阴性乳腺癌患者中显示circSEPT9 IHC评分的点分布图
(G) Kaplan-Meier生存曲线分析图
4. circSEPT9促进三阴性乳腺癌细胞的增殖、迁移和侵袭
为探索circSEPT9潜在生物学功能,作者构建了circSEPT9过表达载体及干扰siRNA(Fig. 4a),分别转染细胞后qPCR检测确定其过表达及干扰效果(Fig. 4b&c),同时用线性SEPT9引物进行检测发现过表达及敲低circSEPT9后对线性SEPT9基因的表达水平没有显著变化(Fig. 4d)。经克隆形成,CCK8及EDU分析其细胞生物表现变化,结果显示:
(1). 干扰circSEPT9显著抑制了三阴性乳腺癌细胞的增殖能力(Fig. 4e-g)
(2). 过表达circSEPT9能有效增强细胞活力
(3). 干扰circSEPT9抑制了细胞的迁移和侵袭能力。过表达后相反(Fig. 4h-j)
小结:circSEPT9在三阴性乳腺癌细胞中发挥致癌作用
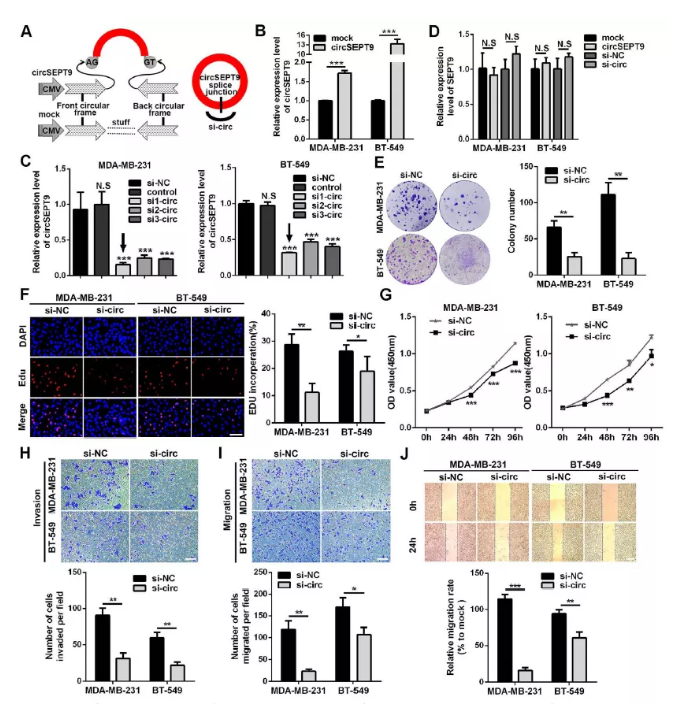
图4 干扰cricSEPT9降低三阴性乳腺癌细胞的生长、迁移和侵袭能力
(A)circSEPT9过表达载体及si-circSEPT9示意图
(B-D)qPCR检测三阴性乳腺癌细胞中circSEPT9过表达及干扰效率
(E) 克隆形成检测细胞增殖能力
(F) EDU检测细胞增殖能力
(G) CCK8检测细胞生长曲线
(H) Transwell检测细胞侵袭能力(×100,100um)
(I&J) 划痕实验检测细胞迁移能力 (*P<0.05,**P<0.01,***P<0.001)
5. circSEPT9下调诱导细胞周期停滞、引发细胞的凋亡和自噬
作者在干扰circSEPT9的基础上,进一步进行了三阴性乳腺癌细胞细胞周期,凋亡和自噬等方面的检测。结果如下:
(1). 细胞周期检测结果显示:干扰circSEPT9后,细胞多分布于G1期,少数分布于S期(Fig. 5a)
(2). Western-Blot实验结果显示干扰circSEPT9后,细胞周期相关蛋白表达下降(Fig. 5b)
(3). 流式细胞术检测凋亡实验结果显示:下调circSEPT9后,细胞凋亡率显著升高(Fig. 5c)
(4). TUNEL分析结果进一步证实了流式的结果(Fig. 5d)
(5). Hoechst33342染色实验结果发现干扰circSEPT9后乳腺癌细胞出现典型核收缩,核破裂等凋亡等特征(Fig. 5e)
(6). WB检测凋亡相关蛋白结果显示:下调circSEPT9后,凋亡相关蛋白caspase-3和凋亡蛋白Bax的表达量增加,Bcl-2的表达水平降低
(7). 通过IF免疫荧光检测显示自噬相关指标LC3-II在干扰circSEPT9组中增加(Fig. 5g),自噬相关蛋白ATG5和ATG7显著增加(Fig. 5h)
小结:circSEPT9参与调节细胞周期,凋亡及自噬等相关过程
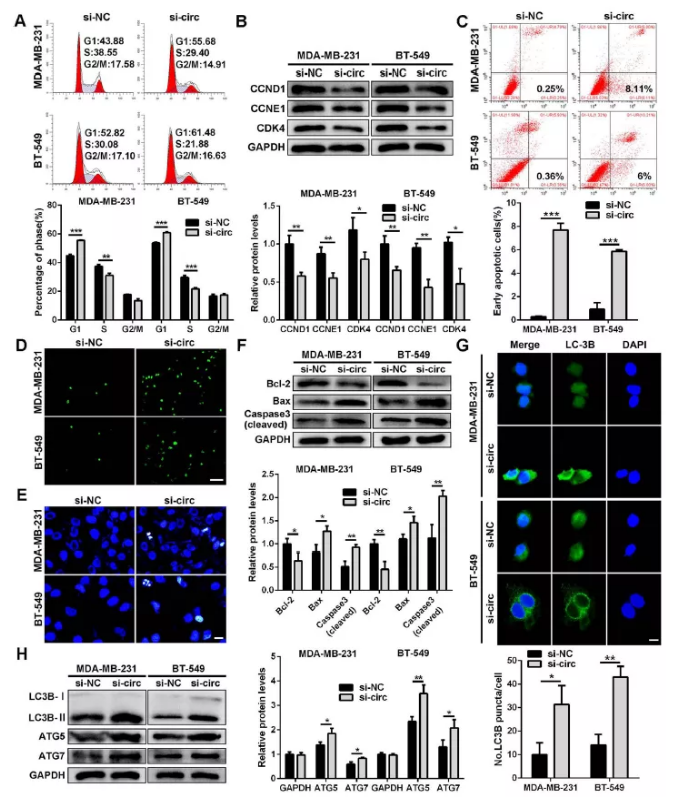
图5 干扰circSEPT9诱导三阴性乳腺癌细胞周期停滞,细胞凋亡和自噬
(A)干扰circSEPT9后流式检测细胞周期
(B)干扰circSEPT9后,WB检测三阴性乳腺癌细胞中细胞周期相关蛋白表达
(C)干扰circSEPT9后,流式细胞细胞术检测细胞凋亡
(D)干扰circSEPT9后,TUNEL染色观察细胞凋亡
(E)干扰circSEPT9后,Hoechst33342染色观察细胞凋亡形态学特征
(F)干扰circSEPT9后,WB检测凋亡相关蛋白表达水平
(G) IF免疫荧光检测LC3-3B荧光强度
(H) WB检测自噬相关蛋白表达水平(*P<0.05,**P<0.01,***P<0.001)
6. circSEPT9与mir-637直接互作并抑制其活性
为探究circSEPT9潜在分子机制,作者通过生物信息学分析预测其可能结合miRNA数据信息,最终确认mir-637作为其互作靶位点。通过qPCR检测过表达及干扰circSEPT9后对应mir-637的表达,并采用双荧光素酶进行互作验证,FISH检测其定位情况,并经circRNA pull dwon进一步验证,结果汇总如下:
(1). 过表达circSEPT9后,mir-637表达量下降,干扰组则相反(Fig. 6a)
(2). 60例临床样品检测mir-637表达,结果显示其在正常组织中高表达(Fig. 6b)
(3). 双荧光素酶实验结果显示,添加mir-637 mimics后circSEPT9野生型组中荧光素酶报告基因的活性降低,突变组无变化,说明circSEPT9与mir-637直接结合(Fig.6e)
(4). 通过FISH共定位检测发现二者均定位在细胞质中
(5). 进一步通过构建生物素标记的circSEPT9探针进行circRNA Pull down实验拉取互作RNA,并通过qPCR检测miR-637表达变化,进一步证实二者互作结合(Fig. 6h)
小结:circSEPT9与mir-637互作
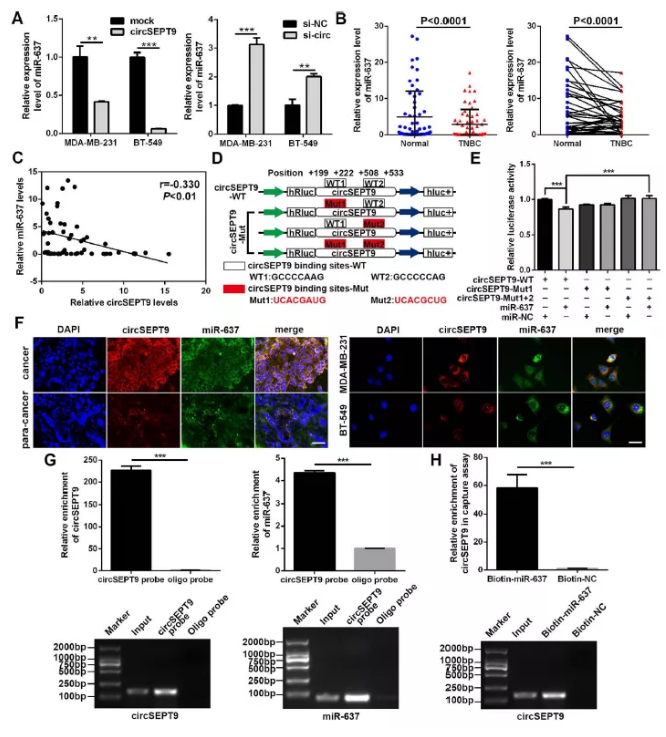
图6 circSEPT9充当mir-637海绵
(A)过表达及干扰circSEPT9后,qPCR检测mir-637
(B) 60例临床三阴性乳腺癌及对照样品中检测mir-637
(C) 皮尔逊相关分析
(D) 双荧光素酶预测结合位点示意图
(E) 双荧光素酶检测实验
(F) circSEPT9及mir-637共定位检测
(G) circRNA pull down检测实验
7. mir-637与circSEPT9共转染功能研究
为进一步研究circSEPT9与mir-637互作功能的相关作用,作者在三阴性乳腺癌细胞中进行共转染实验,结果显示:
(1). mir-637过表达基础上进行circSEPT9过表达后显著减弱了细胞增殖、迁移及细胞侵袭能力
(2). 在干扰circSEPT9的基础上进一步干扰mir-637后能逆转circSEPT9造成的表型变化
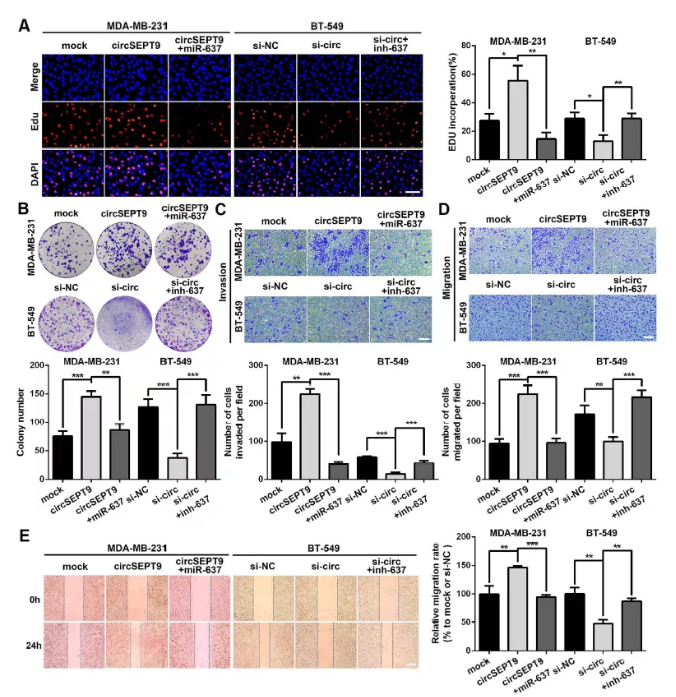
Fig. 7 mir-637可以部分逆转circSEPT9对三阴性乳腺癌细胞的增殖及迁移作用
(A&B) EDU检测细胞增殖
(C-E)三阴性乳腺癌细胞中的侵袭和迁移检测
8. LIF确认为mir-637靶基因激活LIF-STAT3通路发挥作用
为进一步确认确认调控路径,作者通过Targetscan(http://www.targetscan.org),miRanda(http:// www.microrna.org)以及Findtar在线程序(http://bio.sz.tsinghua.edu.cn),最终确认LIF作为mir-637下游保守靶位点。作者通过一系列实验对筛选下游靶基因LIF进行检测,结果如下:
(1). qPCR及wb检测结果显示:在过表达mir-637后,LIF表达量下降,干扰后则相反(Fig. 8a&b)
(2). 双荧光素酶检测实验对mir-637及LIF结合情况进行验证,结果显示:mir-637 mimics转染组可以显著降低LIF野生型组中的荧光值,突变组中无明显变化(Fig. 8c&d)
(3). 免疫组化IHC及IF免疫荧光检测显示:LIF在三阴性乳腺癌组织上调(Fig. 8e&f)
(4). 皮尔逊相关分析表达LIF的表达与mir-637负相关(Fig.8h)
(5). 相关分析表明LIF的表达与circSEPT9呈正相关(Fig. 8i)
(6). qPCR及IF分析表明过表达circSEPT9后,LIF表达量显著增加,干扰后则下降(Fig. 8k&l)
(7). 进一步结果显示:过表达circSEPT9上调LIF,p-STAT3、ID1及MDM2,使P53及P21表达下降,干扰后发挥相反的作用。
小结:circSEPT9可以作为mir-637的海绵激活LIF-STAT3途径促进三阴性乳腺癌变过程
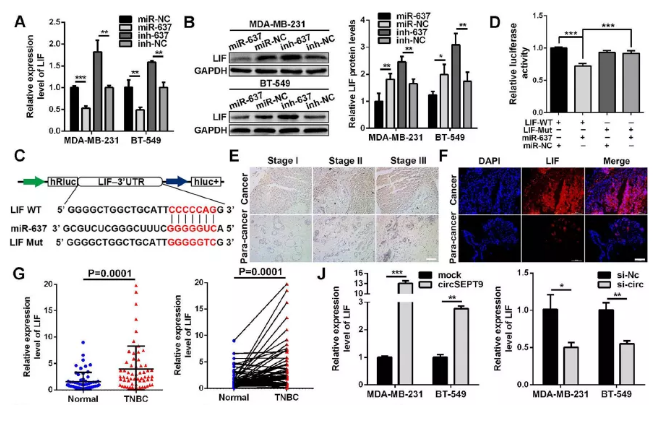
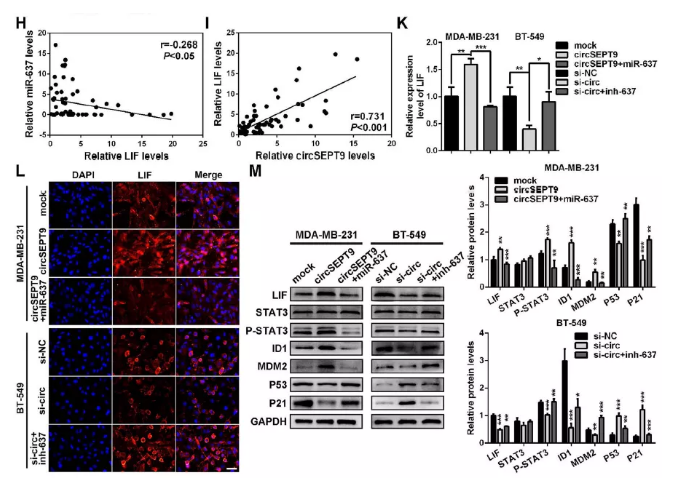
Fig. 8 circSEPT9可以作为mir-637的海绵激活LIF-STAT3途径促进三阴性乳腺癌变过程
(A&B)qPCR及WB检测mir-637过表达及干扰后LIF变化
(C&D)双荧光素酶检测验证mir-637与LIF互作结合
(E&F) IHC及IF评估LIF的相对表达
(G)临床60例三阴性乳腺癌及癌旁样本中qPCR检测LIF
(H&I) 临床样品中mir-637,circSEPT9与LIF相关分析
(J)qPCR检测过表达及干扰circSEPT9后LIF表达
(K)共转染后LIF表达检测
(L) IF检测共转染后细胞中LIF表达
(M)LIF及下游LIF-STAT3途径相关蛋白表达检测
小结
作者从circRNA测序表达谱中专注于circSEPT9的机制研究,分别从生物学功能及机制方面对其在三阴性乳腺癌发生发展过程中的调控机制进行研究,最终确认circSEPT9可以作为新的诊断和预后或治疗标记物。
最新动态
-
04.22
一文读懂EMSA技术核心要点,让“emsa” 秒变“easy”
-
04.02
4·2世界孤独症日 | 聆听“星”声“泌”语,让爱来,让碍走
-
04.01
酵母杂交核心技术:深度Q&A帮你轻松突破实验瓶颈
-
03.19
【客户文献解读,IF>11】食管癌的"隐形推手":MALR-ILF3-HIF1a轴的强大作用
-
03.18
siRNA介绍及药物研发的现状前景
-
03.18
知无不“研”|5篇高分文献带你一览高通量酵母杂交的非凡魅力~
-
02.27
【客户文章分享】SHMT2 通过 5′UTR 依赖性 ADAM10 翻译启动介导小分子诱导的阿尔茨海默病病理学缓解过程
-
01.24
客户文献解读 | 中医为什么能治流感?是玄学还是运气?INT J NANOMED揭示鱼腥草抗病毒机制及范围!
-
01.24
客户文献分享,IF>11|Shank3:脑缺血再灌注损伤的守护者,揭示神经保护的新篇章
-
12.27
文献解读 | 高密度脂蛋白通过miR-181a-5p调控自噬影响血管新生










