转染效率低、干扰效果差、重复性欠佳...siRNA研究频遇“拦路虎”怎么办?别怕,一文教你轻松KO
在现代生命科学研究的舞台上,小干扰RNA(Small Interfering RNA, siRNA)犹如一把精准调控基因表达的“手术刀”,以其高度特异性和高效性在基因沉默领域展现出了无可比拟的优势。siRNA,这一由双链RNA分子组成的短片段,通过与细胞内特定mRNA序列精确互补配对,触发RNA干扰(RNA Interference, RNAi)机制,有效抑制对应基因的翻译,从而实现对基因功能的临时、可逆性关闭。这一关键性技术不仅为研究人员打开了深入探究基因功能、解析复杂生物学过程的大门,更为疾病的分子机制研究、药物靶点筛选以及基因疗法开发提供了强大的工具。
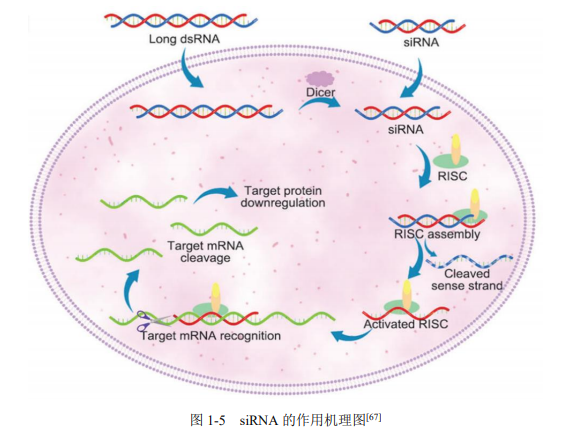
图源:https://www.cnki.net
siRNA的应用领域广泛而深远,无论是基础研究中的基因功能验证、信号通路解析,还是转化研究中的药物靶标验证、疾病模型构建,乃至临床研究中的个性化治疗探索,siRNA都以其独特的技术优势发挥着不可或缺的作用。其高度定制化特性使得研究人员能够针对任何已知基因设计并合成特定siRNA,实现精准的基因敲低,极大地推动了生命科学各个领域的研究进程。
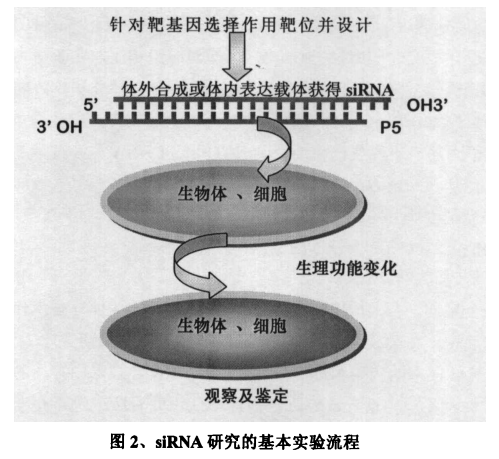
图源:https://www.cnki.net
然而,尽管siRNA技术的潜力与价值毋庸置疑,实际应用过程中仍会面临诸如转染效率、实验重复性、基因干扰效果等一系列技术挑战。这些问题的妥善解决对于充分发挥siRNA技术的潜力,确保研究结果的准确性和可靠性至关重要。武汉金开瑞生物工程有限公司是一家专业致力于为全球制药企业、诊断试剂企业、科研试剂研发企业、高校和科研院所以及大型医院提供核酸及蛋白相关研究技术服务的高新技术企业。自2013年成立以来,我们已经积累了超过10年的项目经验,并拥有专业的技术团队。接下来,我们将针对siRNA研究中常见的问题进行深入探讨,并提供科学、实用的解答与应对策略。
Q:siRNA转染常见问题与建议有哪些?
A:为保证诱饵蛋白功能的完整性,首先我们会考虑用3’AT/ABA进行背景抑制,但是由于这两种试剂对酵母生长具有较大的毒性,后续可能会影响文库筛选,因此在3’AT超过15mM,ABA超过1200ng/ml时我们会考虑将诱饵蛋白进行截断,通过查阅文献和相关数据库,截去转录激活的区域,但是需要注意的是,截去的这一部分很有可能会影响到互作结果。
Q:siRNA转染常见问题与建议有哪些?
A:
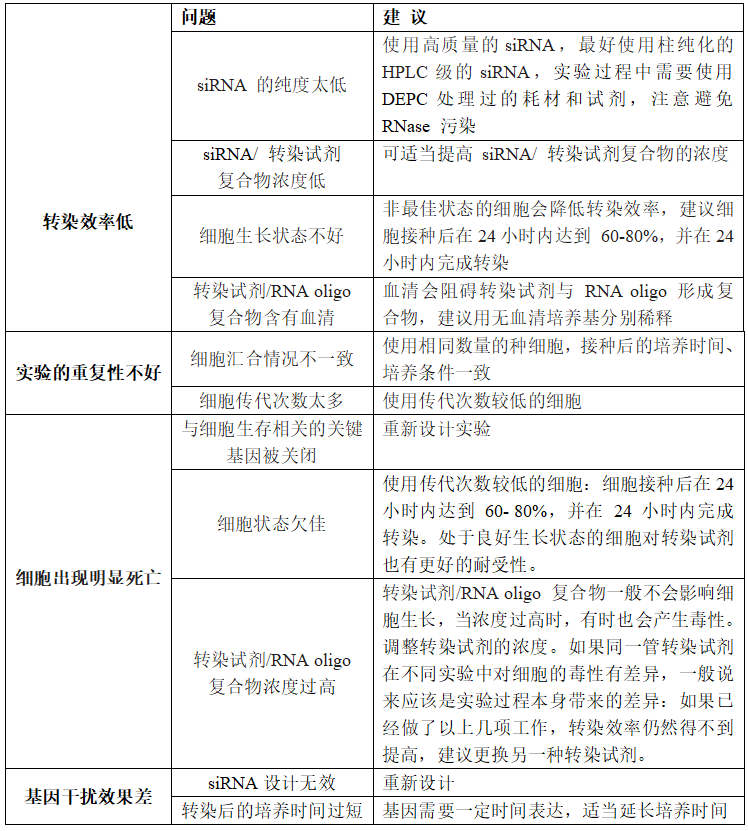
Q:我们需要提供什么信息用于 siRNA 的合成?金开瑞可以帮助免费设计吗?
A:您需要准确地提供 siRNA 的 19 个核苷酸的靶序列和悬垂的合成物,或者您也可以提供相应地基因的 Gene ID 或者 Accession Number,由金开瑞公司技术人员为您免费设计。
Q:用 100nM 的 siRNA 转染时只得到 50%沉默效率,我可以将 siRNA 的浓度增加到 200nM 甚至400nM 吗?
A:增加 siRNA 的浓度一般不能改进沉默效率。高浓度的 siRNA 将可能导致去靶作用和对细胞的毒性。siRNA 的高基因沉默效率来自于合理的设计,在 100nM 甚至更低的浓度都可能有 75%的沉默效率。另外,低的转染效率会导致低的沉默效率,建议您更进一步优化 siRNA 的导入条件。
Q:沉默效果不理想,应该如何处理?
A:最常见的影响沉默效果的两个原因是:转染效率低和 siRNA 序列设计的效果不理想。如果您初次使用 siRNA 或采用了新的细胞系,并发现沉默效果不佳,我们建议您对转染效率进行检测,并选择优化转染条件。如果您已经对实验转染条件进行优化但是问题依然存在,我们建议您换用另一种转染试剂或是采用其他技术,这也许能提高转染效率。如果已经提高了转染效率但是沉默效果仍然未达到要求,可能是因为siRNA序列设计的效果不理想。
Q:一定需要阴性对照吗?
A:是,阴性对照是 RNA 干扰实验中不可缺少的。由于在超过 200nM 的浓度下,siRNA 有可能会导致非特异性的压力反应,在实验体系中必需设置阴性对照。它能够帮助我们确认基因表达水平的降低是否是序列特异性的 RNAi 的结果。由于 siRNA 的合成方法和工艺以及转染试剂等因素可能导致广泛的基因沉默现象。如果没有阴性对照,研究人员很可能错误地将广泛的、非特异性基因沉默当作由 RNAi 引起的基因特异性沉默。
Q:常用的阴性对照有哪些类型?
A:常用的阴性对照大体分为两种,一种是使用通用阴性对照序列,该序列已经被上千篇文章使用;另一类是使用和靶基因 siRNA 打乱序列的 siRNA 作为阴性对照,这样的阴性对照和通用序列相比较,一方面合成是按照定制产品价格合成的,另一方面,由于打乱序列是没有经过验证的序列,有可能会产生 off target 现象。因此,除非有非常特殊的要求,最好使用通用序列作为阴性对照。
Q:在阴性对照体系中和实验体系中观察到同样的实验结果,这是什么原因?
A:这个结果充分说明了设置阴性对照的必要性。该结果表明您所观察到的表型不是序列特异性knockdown产生的表型,您需要降低 siRNA 的工作浓度。
Q:用于对照的 siRNA 的最佳浓度是多少?
A:阳性对照和阴性对照的 siRNA 的浓度都应该与基因特异性的 siRNA 的浓度相同。
Q:在 siRNA 上进行标记的最佳位点在哪里?
A:反义链的 5'端标记会影响 siRNA 的沉默活性,所以不推荐标记这个位点。在其他三个末端进行标记对沉默活性几乎没有影响。有研究表明正义链的 5'端标记是最有效的化学合成位点。
Q:金开瑞siRNA套餐有什么优势?
A:订购金开瑞siRNA套餐,资深技术设计siRNA,在保证细胞转染效率(≥80%)的前提下,siRNA可达到70%以上的沉默效果。若经qRT-PCR鉴定,套餐中3对siRNA均未达到70%或以上的沉默效果,金开瑞将根据您提供的实验结果进行分析。如核实为siRNA设计问题,则重新设计并免费合成针对靶基因的另外3对siRNA。特殊物种(除人,小鼠,大鼠以外)及lncRNA除外。
Q:金开瑞的siRNA套餐包含哪些内容?
A:金开瑞的siRNA套餐里面含有针对目的基因设计的3条siRNA,赠送普通NC,NC-FAM,阳性对照。
1、NC-FAM:实验开始前,请先用NC-FAM进行预实验,根据您用的转染试剂说明书转染NC-FAM,换液后可通过荧光直接观察明确最佳转染效率后再进行后续实验安排。一般情况FAM在转染后48小时内就会淬灭。
2、阳性对照用途:提供的GAPDH siRNA均为验证过有效的siRNA。如果实验组和GAPDH组都未出现有效下调则有可能实验转染步骤存在问题,请优化实验条件后再进行相应实验。
3、NC:用于确保实验过程中其它因素导致了目的基因的RNA水平变化。NC组实验结果应与空白组实验结果一致。
Q:siRNA 导入到细胞内选哪种方法?
A:使用什么样的转染方法,很大程度上取决于您使用的细胞系:1.贴壁的、易转染的细胞,我们推荐使用 Lipofectamin 2000 或 siRNA Mate 转染试剂。2.悬浮的或原代的细胞,我们推荐使用电击转化方法;3.电击转化效率仍然很低的细胞,需要选择载体系统。
Q:刚开始接触 RNA 干扰技术,经费有限,如何确定研究体系?
A:在开始 RNA干扰研究之初,需要确定以下几个方面:使用化学合成的 siRNA 还是使用载体构建 shRNA?我们推荐使用化学合成的方法来筛选有效的目的片段,然后把筛选出来的目的片段插入到载体,进行抗性筛选,得到稳定表达的细胞株,再做长期研究。
Q:反义核酸和 RNAi 有何差异?
A:反义核酸和 RNAi 从作用原理到使用的范围都有很大差异。这里只能做一个简单的介绍:从原理上说,反义核酸是一段与靶基因配对的单链 DNA 或类似 DNA 的片段与靶基因结合,结果阻止靶基因的转录或是翻译,以往的研究表明在反义核酸的研究中,序列的有效性和有效序列的非特异性往往有比较高的正相关性,这就在一定程度上限制了反义核酸的应用。RNAi的作用机理是双链的RNA进入细胞内,导致靶基因的切割和降解。siRNA 的序列可以选择在高度特异针对靶基因的位置,也就为RNAi作为药物研究提供了高效、低副作用的空间。自从RNAi技术问世以来,国外很多专业从事反义核酸研究的公司都纷纷转向 RNAi研究。
在致力于推动siRNA技术广泛应用,助力科研人员攻克研究难题的过程中,我们深感责任重大。为了让更多科研工作者能够便捷、经济地获取高质量siRNA产品,享受到前沿基因沉默技术带来的科研红利,我们将特别推出一场史无前例的siRNA促销活动,全年最低,绝对的惊喜价!详情请联系您的对接销售或官方客服,期待与您携手合作,共同开启基因沉默研究的新篇章!

参考文献:
J. Shen, W. Zhang, R. Qi, et al., Engineering functional inorganic-organic hybrid systems: advances in siRNA therapeutics [J]. Chemical Society Reviews, 2018, Vol.47 (6): 1969-1995.
https://www.cnki.net
RNAi 技术在抑制 H B V 复制和表达中的应用
最新动态











