发现蛋白质组和靶向蛋白质组联合揭示口腔鳞癌预后诊断标志物
信息来源:金开瑞 作者:genecreate 发布时间:2018-11-28 16:25:36
题目:Combining discovery and targeted proteomics reveals a prognostic signature in oral cancer
发现蛋白质组和靶向蛋白质组联合揭示口腔鳞癌预后诊断标志物
期刊:Nature Communications
影响因子:12.353
主要技术:Label free
研究背景
口腔鳞癌(ral squamous cell carcinoma,OSCC)是头颈部恶性肿瘤的最常见类型,表现出高患病率和发病率,OSCC不同组织区域具有特定的组织病理学和分子特征,限制了基于肿瘤-结节-转移(tumor−node –metastasis,TNM)标准的临床分期,接受标准治疗的患者OSCC复发率在18%至76%之间。因此,评估OSCC患者的预后结果的生物学标志物具有重要的临床意义。
研究内容及结果
1. OSCC蛋白表达谱
作者选取了20例OSCC患者的石蜡包埋组织,并对组织中的6个区域进行Label free定量蛋白质组学检测分析(图1,图2a-b),共定量到2049个蛋白质,发现在ITF(距肿瘤切片边缘1mm深度组织)和内部肿瘤(距离上皮肿瘤组织起源1mm组织)的肿瘤岛存在32个差异表达蛋白,肿瘤基质中存在101个差异表达蛋白。层次聚类分析不仅显示了来自ITF和内部肿瘤的样品之间的蛋白质组多样性,还显示了肿瘤岛蛋白和肿瘤基质蛋白差异(图2c-d)。为了研究生物过程是否可以在空间上将肿瘤岛与肿瘤基质分开,作者进行了GO富集分析,发现肿瘤岛蛋白多参与细胞代谢过程,肿瘤基质蛋白多参与细胞粘附过程等(图2g)。最后,作者结合生信分析和线性回归分析,确定了14种与病人特征相关的蛋白(表1)。
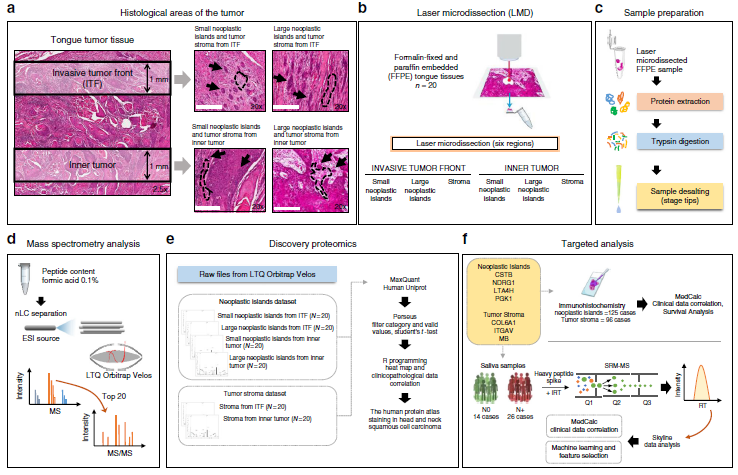
图1 技术路线
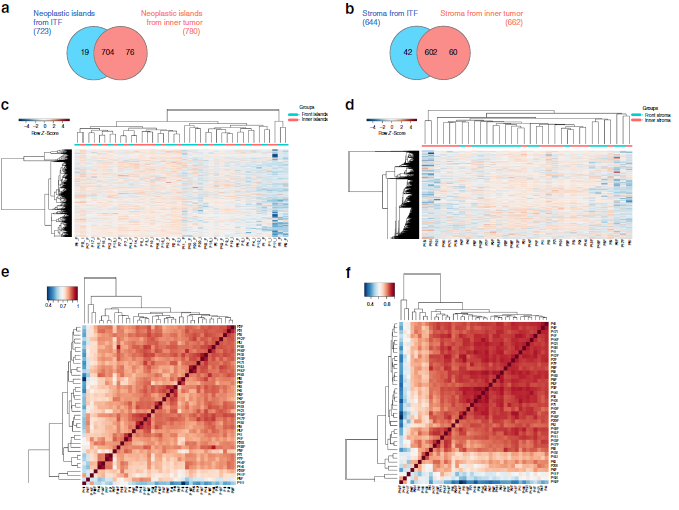
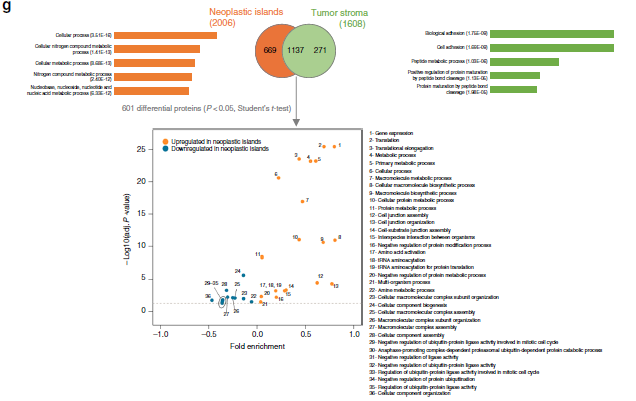
图2 蛋白质组学分析
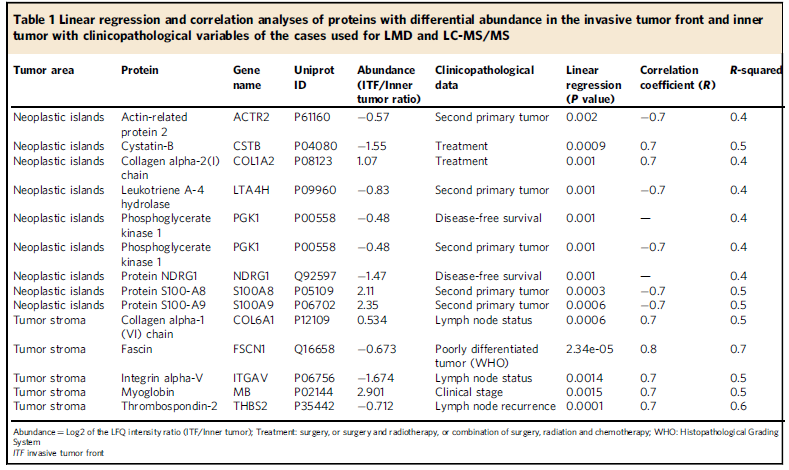
表1 与OSCC相关蛋白列表
2. IHC验证靶蛋白
上面这些候选蛋白对于后续的IHC和靶向蛋白质组学验证来说数目仍然较多,因此,作者基于更严格的条件进行过滤:(1)在ITF和内部肿瘤存在的差异表达蛋白;(2)与患者临床特征显着相关的蛋白质;(3)在人类蛋白质图谱中具有鳞状细胞癌阳性染色的蛋白质(https://www.proteinatlas.org/);(4)选择未见报道或者仅有少数报道跟口腔鳞癌相关的蛋白。基于上述原则,作者共挑选出7个候选蛋白: CSTB、LTA4H、NDRG1、PGK1、COL6A1、ITGAV、MB。
作者首先选择了原始样本中的14例OSCC病人石蜡包埋组织对上述7种蛋白进行IHC验证,结果和蛋白质组学结果一致。随后,作者将样本量扩大,包括125例肿瘤岛组织和96例肿瘤基质组织进行IHC验证(图4)。发现扩大样本量后大多数IHC结果与原始14例IHC病例相似,但是随着数据队列的增加,LTA4H、PGK1和ITGAV染色鉴定区域(ITF或内部肿瘤)略有变化,说明靶蛋白对于其鉴定细胞具有一定的特异性。
为了增加靶蛋白预后诊断标志的可信度,作者将IHC结果与临床病理学特征结合,发现临床病理参数和CSTB、PGK1、COL6A1和ITGAV显著关联。OSCC患者生存分析表明,ITF中CSTB和NDRG1的低表达分别与局部复发和第二原发肿瘤相关,PGK1和ITGAV的高表达与局部复发和淋巴结复发相关。CSTB、PGK1和ITGAV对于5年疾病特异性存活和无病存活具有显著性,NDRG1仅对5年无病生存率具有显著性。

图3 候选蛋白丰度曲线
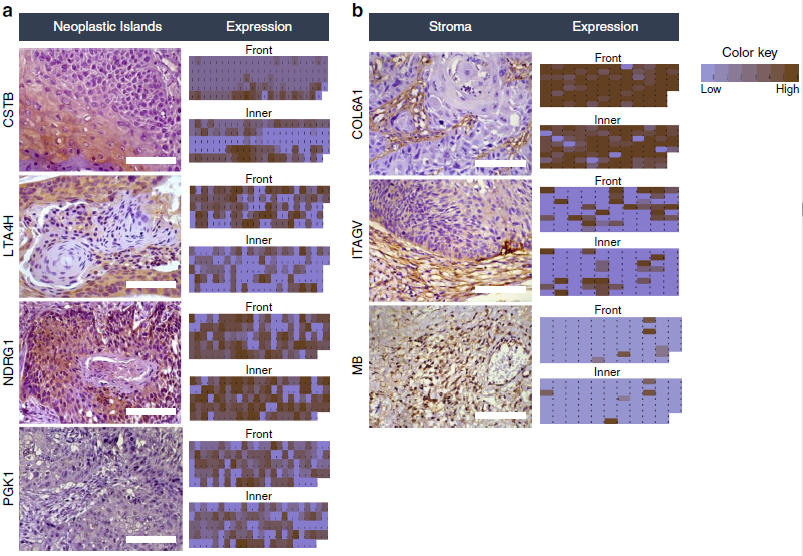
图4 靶蛋白IHC验证
3. SRM-MS靶向蛋白质组验证靶蛋白
接下来作者选取了40例病人唾液对上述7个靶蛋白进行靶向蛋白质组学验证。样本共分成了两组:无淋巴结转移的患者(N0)和已经发生淋巴结转移的患者(N+)。结果发现,和N0组相比,有6种蛋白(CSTB、LTA4H、PGKI、NDRG1、COL6A1和ITGAV)在N+中蛋白表达丰度较低(图5a,c)。此外,作者基于两种质谱数据采集模式(DDA和SRM)的组织和唾液蛋白之间的关系进行了分析,发现大多数蛋白质在ITF和唾液部位表现出较低的丰度,这与预后不良相关。唾液样品中LTA4H、PGK1、NDRG1、COL6A1和ITGAV蛋白的低表达与淋巴结转移和晚期临床分期相关。
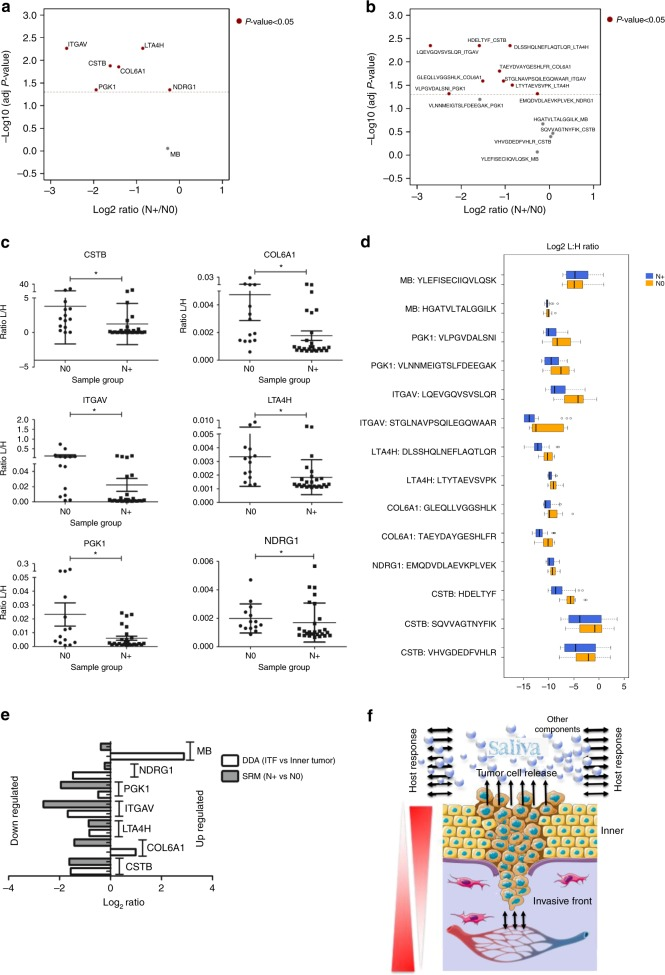
图5 靶向蛋白质组学验证
文章小结
发现蛋白质组即定量蛋白质组能够在空间上绘制肿瘤岛及其周围的OSCC基质的蛋白质组,鉴定具有潜在预后价值的蛋白质,并通过IHC和靶向蛋白质组学SRM-MS进行验证,有助于推动预后决策,促进精确的治疗方案和减少肿瘤局部复发或淋巴结转移。IHC表明ITF的肿瘤岛中CSTB低表达可作为局部复发的独立标志物。总之,作者运用高通量蛋白质组学分析筛选,靶向蛋白质组学验证的方法,确定了预后表征蛋白,增强OSCC的预后决策,更好地指导治疗,以减少肿瘤复发或淋巴结转移。
解析文献
Carolina Moretto Carnielli, Carolina Carneiro Soares Macedo, et al. Combining discovery and targeted proteomics reveals a prognostic signature in oral cancer. Nature Communications, 2018, DOI: 10.1038/s41467-018-05696-2
参考文献
1. Alfonso, P., Cañamero, M., et al. Proteome analysis of membrane fractions in colorectal carcinomas by using 2D-DIGE saturation labeling. J. Proteome Res, 2008, 7, 4247–4255.
2. Schaaij-Visser, T. B. M. et al. Differential proteomics identifies protein biomarkers that predict local relapse of head and neck squamous cell carcinomas. Clin. Cancer Res, 2009 15, 7666–7675.
3. Chi, L.-M. et al. Enhanced interferon signaling pathway in oral cancer revealed by quantitative proteome analysis of microdissected specimens using 16O/18O labeling and integrated two-dimensional LC-ESI-MALDI tandem MS.Mol. Cell. Proteom, 2009, 8, 1453–1474 .
4. Vizcaíno, J. A. et al. ProteomeXchange provides globally coordinated proteomics data submission and dissemination. Nat. Biotechnol, 2014, 32, 223–226.
5. Winck, F. V. et al. Insights into immune responses in oral cancer through proteomic analysis of saliva and salivary extracellular vesicles. Sci. Rep. 2015, 5, 16305.
6. Harris, T. M. et al. Proteomic analysis of oral cavity squamous cell carcinoma specimens identifies patient outcome-associated proteins. Arch. Pathol. Lab. Med.2015, 139, 494–507.
7. Kawahara, R. et al. A targeted proteomic strategy for the measurement of oral cancer candidate biomarkers in human saliva. Proteomics, 2016, 16, 159–173.
上一条:SWATH-MS的那些事
下一条:简述外泌体及其蛋白质组学研究
最新动态
-
07.30
一文带你全方位解析ChIP技术
-
07.30
双荧光素酶实验-从文献实例看核心应用方向
-
07.17
探秘LCA:荧光素酶互补技术详解及高分文献分享
-
07.15
表观研究双雄:ChIP-seq和CUT&Tag,谁更适合你?
-
07.04
Molecules | 从山茶花中分离出的肠膜明串珠菌subsp. DB-21 衍生的外泌体具有美白和抗炎活性
-
07.03
Int J Nanomedicine|古代药用昆虫土鳖虫来源的细胞外囊泡样颗粒:通过褪黑素增强自噬活性促进骨形成治疗骨质疏松症
-
07.02
Viruses |从香菇衍生的囊泡状纳米颗粒中鉴定出一种针对 SARS-CoV-2 Omicron 变体的新型抗病毒凝集素
-
06.27
Foods | 黑果枸杞类外泌体提取工艺优化及其对HT22细胞中AB诱导的细胞凋亡和氧化应激的抑制作用
-
06.23
科研小白必看的Co-IP结果解读
-
06.19
史上最全的ATAC-seq实验技术详解










