Viruses |从香菇衍生的囊泡状纳米颗粒中鉴定出一种针对 SARS-CoV-2 Omicron 变体的新型抗病毒凝集素
发表在《Viruses》期刊上的题为"Identification of a Novel Antiviral Lectin against SARS-CoV-2 Omicron Variant from Shiitake-Mushroom-Derived Vesicle-like Nanoparticles"的研究。凝集素是一类能与碳水化合物结合的蛋白质,其抗病毒活性可能通过结合病毒颗粒表面的聚糖干扰病毒入侵实现。从香菇(Lentinula edodes)源囊泡样纳米颗粒(VLNs,或称外泌体)中鉴定出一种新型凝集素(命名为Shictin),针对COVID-19大流行中不断演变的奥密克戎变异株(Omicron)的免疫逃逸特性,提出创新性解决方案:通过超速离心法结合蛋白质组学技术,从香菇VLNs中鉴定出新型凝集素Shictin,系统阐明其通过特异性结合病毒表面聚糖抑制奥密克戎变体感染的分子机制,为开发广谱抗冠状病毒药物提供新策略。

1、研究亮点
● 新型抗病毒凝集素发现:首次从香菇VLNs中分离出凝集素Shictin,对奥密克戎变异株展现纳摩尔级抑制活性(IC50=87 nM)
● 作用机制创新:揭示Shictin通过钙离子依赖的糖识别机制结合SARS-CoV-2刺突蛋白聚糖,阻断病毒入侵
● 技术方法突破:建立植物源VLNs的高效筛选平台,为抗病毒药物开发提供新资源
2、研究思路
(1)VLNs抗病毒活性筛选
通过超速离心法从15种蔬菜(表1)中分离VLNs,采用假病毒中和实验评估其对SARS-CoV-2三种变异株(原始株、Delta、Omicron)的抑制效果。结果显示:香菇、白蘑菇、葱、韭菜、大蒜和韭葱的VLNs对所有三种变异株均表现出显著抑制活性(图1A-C)细胞毒性实验(MTT法)证实,在1×10¹⁰/mL浓度下,所有VLNs样品均未显示显著毒性(细胞存活率65.3%-100%)(图1D)。
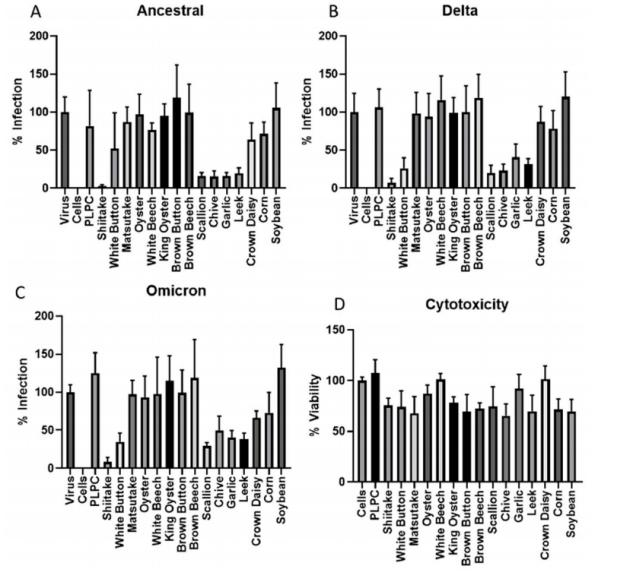
图1. 蔬菜VLNs的抗病毒活性筛选。(A-C) 对原始株、Delta和Omicron假病毒的中和率;(D) VLNs的细胞毒性检测(PLPC为阴性对照脂质体)
四种活性最强的VLNs(香菇、韭葱、大蒜和韭菜)的剂量效应分析显示,香菇VLNs对原始株的EC50值最低(5.2×10⁸/mL)(图2A)。

图2. 蔬菜来源的VLNs对SARS-CoV-2假病毒(武汉Hu-1株)的抑制实验(半数有效浓度EC₅₀): (A) 香菇 (B) 韭葱 (C) 大蒜 (D)韭菜
香菇VLNs对所有变异株均表现最佳抑制活性(原始株EC50=5.2×10⁸/mL)细胞毒性实验(MTT法)证实其在1.7×10⁹/mL浓度下仍保持>60%细胞活力(图3C)。
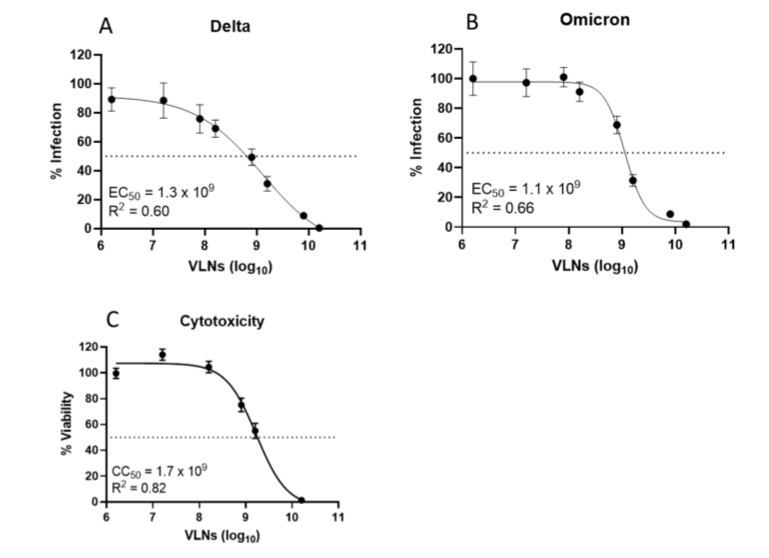
图3. 香菇VLNs对不同SARS-CoV-2假病毒变异株的抑制实验(半数有效浓度EC₅₀): (A) 德尔塔变异株(B) 奥密克戎变异株。 (C)香菇VLNs的细胞毒性实验(CC₅₀)。
(2)香菇VLNs的蛋白质有助于抗病毒活性
通过热处理(95℃ 10分钟)和超声处理对比发现:扫描电镜显示热处理导致VLNs结构塌陷(图4A),热处理显著降低抗病毒活性(**p<0.01),提示蛋白质成分起关键作用(图4B)。
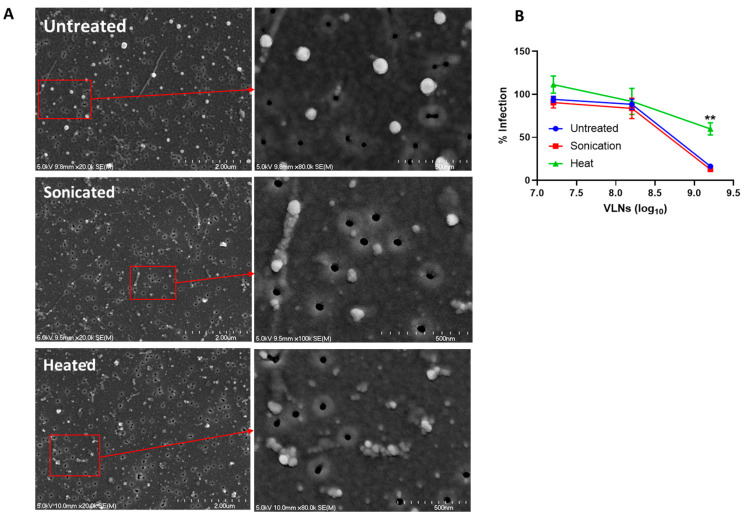
图4:经超声或加热处理的香菇VLNs形态变化及抗病毒功能分析
(A) 扫描电子显微镜(SEM)成像分析:未处理组、超声处理组、加热处理组。
(B) 处理后的香菇VLNs对SARS-CoV-2原始毒株(Ancestral strain)的抗病毒活性测试。显微图像显示未处理组、超声处理组及加热处理组VLNs的低倍与高倍(插图)放大结果。比例尺:主图2 µm,插图0.5 µm。
(3)香菇VLN的凝集素 (Shictin) 有助于抗病毒活性
通过对香菇 VLN 做蛋白质组实验,鉴定出新型凝集素Shictin:全长298个氨基酸,含N端CBD结构域(与α-L-鼠李糖苷酶CBM67家族同源)和独特C端域(图5A)。从这种基于链霉菌α-l-鼠李糖苷酶碳水化合物结合模块67(CBM67)的蛋白质结构模型来看,CBD被认为是抗病毒活性的原因(图5B)。来自纯化蛋白质的清晰 17 kDa 条带出现在 10% PAGE 凝胶中,与 Shictin CBD 预测的大小相匹配(图5C)。

图5. Shictin蛋白的特性分析。(A) Shictin蛋白的序列特征描述; (B)Shictin蛋白的三维(3D)结构模型;(C)从大肠杆菌BL21细胞中纯化的Shictin蛋白;(图示说明:SP,信号肽(绿色);NTD,N端结构域(品红色);CTD,C端结构域(青色);CBD,碳水化合物结合结构域)
作者通过探究发现这些凝集素具有低序列同源性,但具有高结构同源性。将 5 个顶部同源凝集素与它们的序列(图 6A) 和结构 (图 6B) 进行比较。序列同一性范围为 19% 至 44%,但它们的结构同一性显示相同的折叠(典型的 β-jellyroll 折叠)和强叠加,置信度为 100%,RMSD 值在 1.748 和 2.099 之间,TM 评分大于 0.71。这种现象表明,糖对凝集素的识别不是分子特异性的,而是几何形状特异性的。

图6. 五个同源碳水化合物结合结构域(CBD) 与 Shictin CBD 的叠加。(A) 同源 CBD 的蛋白质序列比对。(B) 叠加的同源 CBD 结构。绿色的钙离子 (Ca2+)显示在碳水化合物结合位点(CBS)[56]。TM 分数是从 0 到 1 的标准化分数,代表蛋白质的整体相似性。分数高于 0.5 表示总体折叠相同。
为了破译Shictin CBD 的糖结合,作者对结构进行了进一步分析,并将其与高度同源的Pleurotus ostreatus 凝集素(POL)进行了比较,发现hictin CBD 与这两个 CBD 结构叠加(图7A),并且在碳水化合物结合位点模拟钙依赖性糖结合(图7A-C)。两个天冬氨酸残基(D43 和 D44)在碳水化合物结合位点用于钙基糖(melibiose 或 NAG)结合(图7B 或图7C)。另一个残基,Shictin 中的缬氨酸 (V)97 但凝集素 POL 中的脯氨酸 (P),也有助于该结合位点的碳水化合物结合,从序列比较中确定(图7D)。P/V97 这个位置的序列差异可能与它们的糖结合和功能差异有关 。

图7. Shictin碳水化合物结合结构域的分子模型。(A) Shictin CBD 结构模型(洋红色)与 C 末端结构域(6T1Dct-melibiose,灰青色)和 (6LI7ct-NAG,黄-红色)的凝集素 POL 结构模型。(B,C)显示糖 melibiose 或 N-乙酰-d-葡萄糖胺 (NAG) 在 Shictin CBD 的碳水化合物结合位点的模制碳水化合物结合。(D) Shictin CBD 与凝集素 POLC 末端序列 (6T1D_ct) 和 (6LI7_ct) 的蛋白质序列比较。假设用于糖结合的三个关键残基 (D43、D44 和 P/V97) 以红色框定。
(4)Shictin抑制SARS-CoV-2感染
假病毒和真病毒实验均显示:对Omicron抑制最强(IC50=87 nM),Delta次之(3.2 μM),原始株最弱(图8)结构分析表明该差异与病毒S蛋白糖基化模式演变相关:Omicron的寡甘露糖型聚糖增加提升Shictin结合效率,Vero-E6细胞缺乏TMPRSS2使Omicron更依赖内体途径(易受凝集素干扰)。

图8. Shictin (CBD) 对SARS-CoV-2变异株的抑制实验(半数抑制浓度IC₅₀)。
(A) 对假病毒的抑制作用[原始株(Wuhan Hu-1)、德尔塔(B.1.617.2)和奥密克戎(BA.1) (B) 对活病毒的抑制作用 [原始株(WA1)和奥密克戎(B.1.1.529)]
3、研究结论
● 香菇VLNs是抗病毒凝集素的优质来源,其活性成分Shictin对奥密克戎变异株具有显著抑制效果
● Shictin通过钙离子依赖的糖识别机制结合病毒聚糖,抑制效率与毒株糖基化模式相关
● 该研究为开发针对病毒糖基化特征的广谱抗病毒药物提供新思路
本研究创新性地将食用菌来源的VLNs应用于抗病毒药物开发,未来可进一步优化Shictin的给药系统,并探索其对其他高糖基化病毒(如HIV、流感病毒)的抑制作用。
文献:Wiggins J, Karim SU, Liu B, Li X, Zhou Y, Bai F, Yu J, Xiang SH. Identification of a Novel Antiviral Lectin against SARS-CoV-2 Omicron Variant from Shiitake-Mushroom-Derived Vesicle-like Nanoparticles.Viruses.2024Sep 30;16(10):1546.
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










