DAP-seq:解锁植物转录因子调控密码的高效利器
植物转录因子(Transcription Factors, TFs)作为基因调控网络的“核心开关”,通过精准识别DNA顺式作用元件,指挥着生长发育、逆境响应及代谢重编程等关键生命过程。然而,传统研究技术如染色质免疫沉淀测序(ChIP-seq)长期受限于物种壁垒:
抗体依赖性强:需定制物种特异性抗体,90%非模式植物缺乏可用工具;
体内动态复杂性:细胞内环境干扰(如蛋白互作、翻译后修饰)导致结合信号失真;
周期与成本瓶颈:转基因株系构建耗时≥6个月,单样本成本超万元。
2016年5月,来自美国Salk研究所的科学家们在Cell期刊发表题为“Cistrome and Epicistrome Features Shape the Regulatory DNA Landscape”的文章(IF=28.71)。该研究开发了一项新技术:DAP-Seq(DNA亲和纯化测序),用于快速绘制转录因子调控靶向DNA区域的图谱:顺反组(cistrome)的蛋白质结合区域的景观图。构建完整的顺反组和表观组图谱(epicistrome maps)是阐明生长发育、行为和疾病复杂转录调控网络的重要方法。DAP-seq大大扩展了科学家们收集的关于转录因子及它们结合位点的信息其革命性在于:
跳出生物体限制:通过体外重组TF蛋白与天然基因组DNA(gDNA) 直接孵育,保留甲基化等表观遗传印记;
攻克技术普适性难题:仅需目标物种的gDNA和TF编码序列,即可解析水稻、玉米乃至珍稀蕨类植物的调控机制;
实现“分子快照”级精度:人为添加辅因子(如植物激素受体),动态模拟干旱、高盐等胁迫下的TF结合特异性。
如今,DAP-seq已成为绘制植物“调控基因组图谱”的基石技术——从解码作物抗逆分子模块到挖掘药用植物次生代谢通路,它正加速推动精准育种与合成生物学的革新。
一、技术简介:体外高效捕获TF-DNA互作
DAP-seq巧妙结合体外表达与高通量测序优势:
核心原理:体外表达带标签的TF蛋白 → 与片段化基因组DNA(gDNA)孵育 → 利用标签抗体富集TF-DNA复合物 → 解离DNA进行建库测序。
独特优势:
无需抗体/转基因:规避物种限制,尤其适合非模式植物。
高效低成本:体外表达周期短,通量高。
保留表观印记:可使用天然gDNA(含甲基化等修饰)。
灵活可控:可人为添加辅因子,模拟特定生理环境。
ChIP-seq对比:DAP-seq适用范围扩展至数百种缺乏遗传工具的植物物种。
二、样本准备:成功的关键起点
1. TF蛋白表达
表达系统:麦胚体外表达系统(高效)、哺乳动物或无细胞表达系统。
标签选择:FLAG、HA等小标签(减少空间位阻),避免GST等大标签。
质控:Western blot验证表达效率及完整性。
2. 基因组DNA(gDNA)制备
高质量提取:CTAB法或试剂盒,确保DNA大片段(>20 kb)、低降解。
关键处理:
超声打断:优化至200-500 bp片段(需预实验确定参数)。
质控:凝胶电泳检测片段分布。
三、测序分析流程
文库构建:富集DNA末端修复、加A、接头连接、PCR扩增。
高通量测序:Illumina平台
生物信息学分析方法:
(1)对两个技术重复样本,以及 input 对照的 DAP-seq 文库,使用 NovaSeq,经过高通量测序,获得 PE150bp的fq格式的原始数据。
(2)使用 Bowtie 2(Langmead & Salzberg, 2012),比对到物种基因组上。
(3)使用 MACS(Zhang et al., 2008)callpeak。
(4)使用 IDR 软件(Li et al., 2011),合并两个技术重复样本的 peaks,并且对重复 peak的可靠性打分。
(5)使用 MEME 软件(Machanick & Bailey, 2011),分析 peaks 区域的典型 motif。
(6) 使用 HOMER 软件(Heinz et al., 2010),对 peaks 进行注释。
(7)使用 depTools2 软件(Fidel et al., 2016),分析 reads 在 TSS 附近的分布频率,绘制密度曲线图和对应的热图。统计 peaks 在 TSS(Transcription Start Site)附近的分布频率,可视化 peaks 在染色体上的分布。
四、实验问题解答
|
问题现象 |
可能原因 |
解决方案 |
|
测序后Peak数极少 |
TF失活/标签遮蔽 |
验证蛋白活性,更换小标签 |
|
背景噪音高 |
非特异结合多 |
增加封闭剂,优化盐浓度 |
|
Peak在重复间一致性差 |
gDNA片段化不均 |
校准超声仪参数,预实验优化 |
|
结合位点与已知motif不符 |
辅因子缺失/体外条件偏差 |
添加辅因子,模拟生理环境 |
|
靶基因富集无显著性 |
数据量不足/peak calling阈值不当 |
增加测序深度,调整统计参数 |
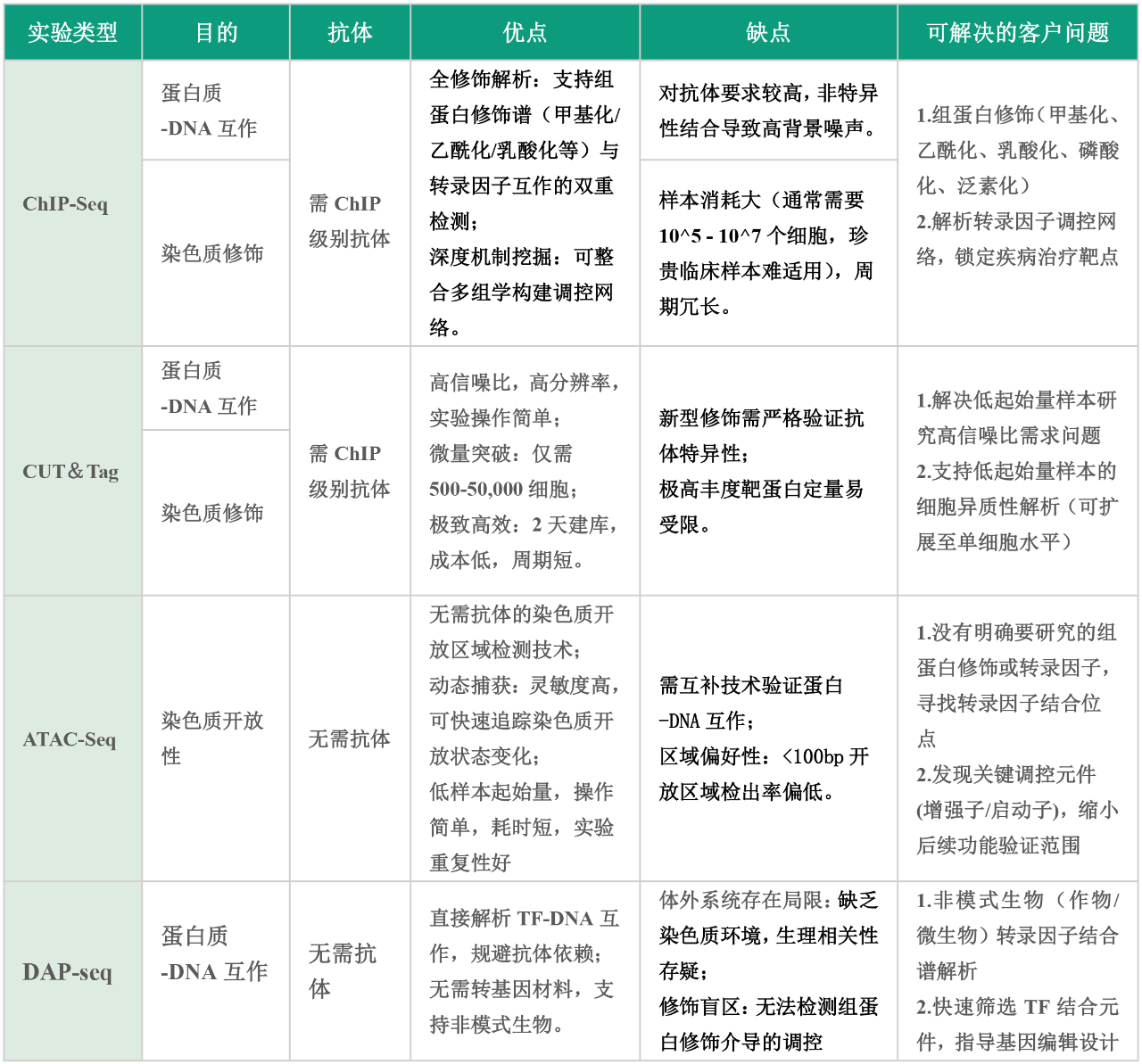
五、DAP-seq和其他技术的区别
在解析基因组功能调控机制的研究中,DAP-seq、ChIP-seq、CUT&Tag和ATAC-seq是揭示蛋白质-DNA相互作用和染色质状态的核心技术。然而,它们在原理、应用场景和目标信息上存在显著差异,接下来我们来看看这几种技术的区别与应用:
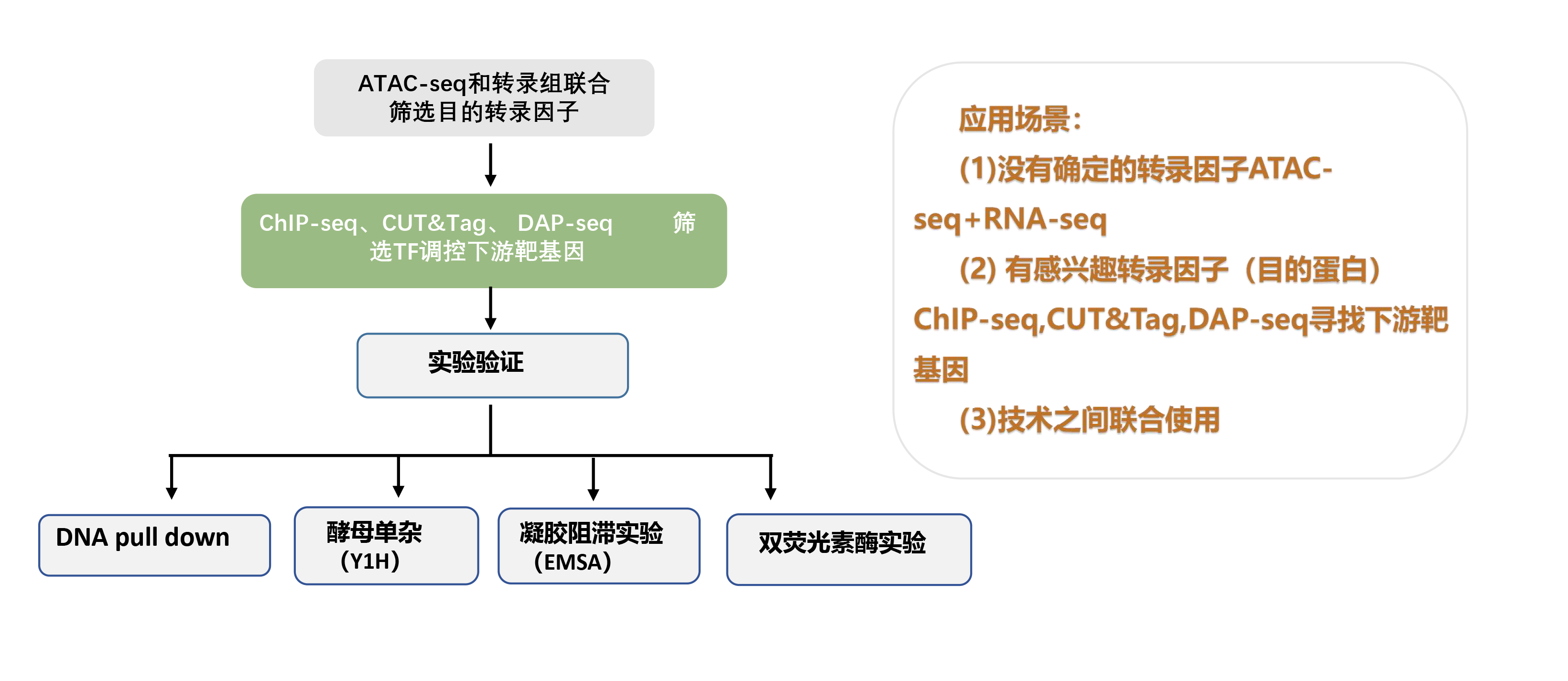
六、DAP-seq如何和他技术进行联合分析?
任何一项技术都存在优点和弊端,单一技术仅能提供调控拼图的片段——DAP-seq的体外结合位点需体内实验验证,ChIP-seq/CUT&Tag依赖抗体且可能遗漏低丰度结合事件,而ATAC-seq的开放区域需进一步衔接具体调控因子。
多组学整合分析 正是突破这一局限的关键路径:通过多种技术联合,我们能够交叉验证TF的特异性结合、区分功能性与背景结合位点、锚定开放染色质中的活性调控元件,并最终构建从"结合潜力"到"体内功能"的动态调控图谱。
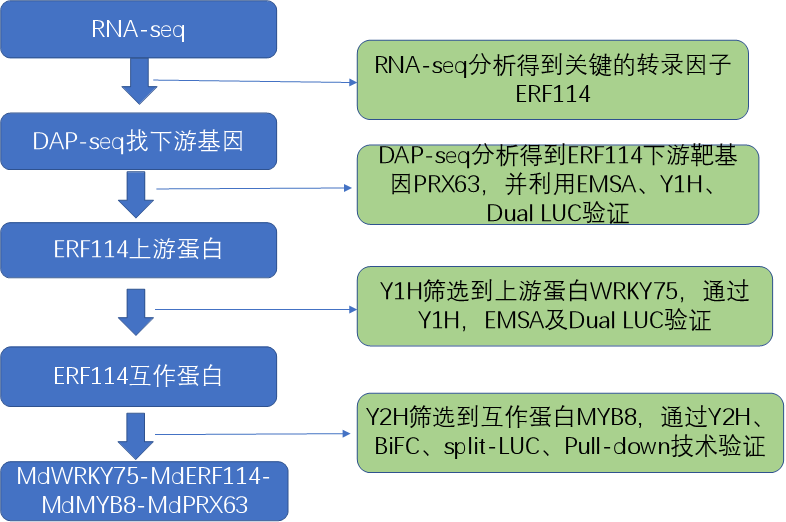
七、案例分析
研究通过 农杆菌介导的根系遗传转化过表达 MdERF114/MdPRX63,为苹果重茬病(ARD)的抗性育种提供新策略,避免化学药剂对环境的危害。首次揭示 MdWRKY75-MdERF114-MdMYB8-MdPRX63 模块通过木质素沉积途径调控苹果抗病性,为果树抗病分子设计育种奠定基础。

多组学联合研究思路:
DAP-seq凭借高效、低耗、无物种限制的优势,正成为植物转录因子研究的主流选择。无论是初探TF调控网络,还是解析抗逆分子机制,它都能提供高分辨率的DNA结合图谱。金开瑞可以提供DAP-seq、ATAC-seq、ChIP-seq和CUT&Tag技术服务,期待与您携手合作,共同推动生命科学的发展。
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










