凝胶迁移实验(EMSA)要点剖析!
今天给大家带来分子生物学研究中的一项重要技术——凝胶迁移实验(Electrophoretic Mobility Shift Assay, EMSA)的详细解析。这项技术是研究DNA-蛋白质相互作用的"黄金标准"!EMSA又称凝胶阻滞实验,主要用于检测蛋白质与特定DNA或RNA序列的结合情况。通过观察复合物在凝胶电泳中的迁移率变化,我们可以直观地看到蛋白质与核酸的结合。
01、实验应用
(1)用于研究DNA结合蛋白和特定的DNA序列的相互作用;
(2)可用于DNA定性和定量分析;
(3)用于研究RNA结合蛋白和特定的RNA序列的相互作用。

02、实验优缺点
实验优点:
➤灵敏度高:使用放射性同位素标记的核酸,EMSA可以在低蛋白和核酸浓度下进行检测。
➤适用范围广:适用于不同大小和结构的核酸,以及从小肽到大型转录复合物的多种蛋白质。
➤操作简便:基本技术简单,但足够稳健,可以适应广泛的结合条件。
实验缺点:
❖EMSA基于蛋白天然构象与核酸的某一段区域结合而发生相互作用,因此不能找到具体蛋白的何种氨基酸位点或区域,与核酸的片段相互作用,结果有局限性。
❖在处理未纯化或部分纯化的细胞提取物时,它们含有许多核酸结合蛋白,因此,需要进行与EMSA互补的其他技术,以阐明哪种蛋白质导致了电泳迁移率转变。
❖迁移率受多种因素影响:除了复合物的大小,电泳迁移率还受蛋白质电荷、核酸等多种因素影响。
03、实验样本准备
(1)单块胶重组蛋白不少于50ug(NTA或TE溶,不含变性剂),浓度不低于0.2mg/mL;
(2)细胞量:约1*10^7个细胞,或者1个10cm培养皿,细胞密度达到80-90%;
(3)动物组织:不少于0.2g,新鲜取材;
(4)植物组织:不少于0.5g,新鲜幼嫩组织;
(5)超迁移EMSA需提前准备IP级别抗体,不少于10μL ;
(6)样本制备可以选择样本的总蛋白、核蛋白或者使用纯化好的目的蛋白,对样本进行定量,实验组各组中加入等量蛋白 ,浓度⼤于100ng/μL (或者OD值0.5-0.7),⽢油菌200-500μL 菌,新鲜菌液,保存3个⽉以内的。
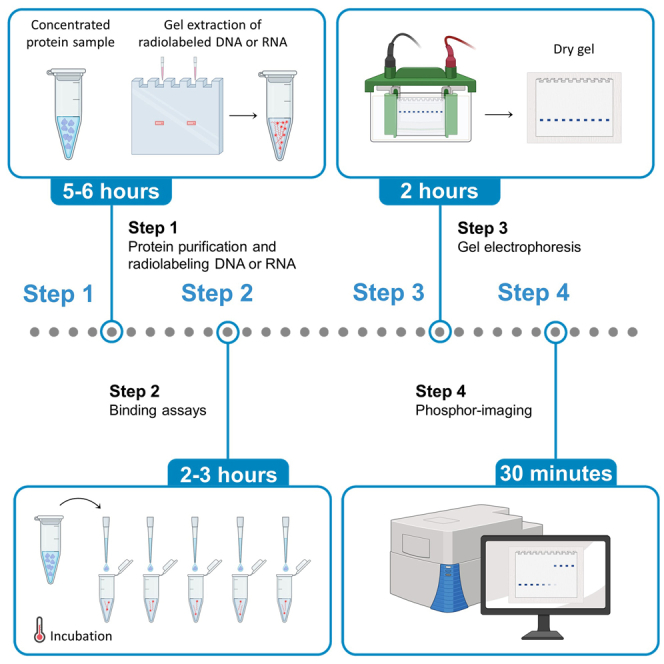
04、核心实验流程
1.PAGE胶的配制
准备好倒胶的模具,选择1.0mm模具。制胶前必须把制胶模具冲洗干净,需特别注意不能有SDS和DTT等变性剂残留,配制聚丙烯酰胺凝胶,加入TEMED前先混匀,加入TEMED后立即混匀,并马上加入到制胶的模具中,要注意避免产生气泡,并插入梳子。37℃恒温箱静置1h待胶完全凝固。
2.(蛋白与探针结合)制备体系
一般设置分组通常为:阴性对照、阳性对照、实验组、探针冷竞争反应(需加入竞争型冷探针)和超迁移反应(需加入抗体)等,按照一定的配比加入无菌水,结合缓冲液,TBE,总蛋白/纯化蛋白以及标记好的探针。
3.样品孵育
加入标记好的探针前先混匀,并且室温(25℃)放置10min,从而消除可能发生的探针和蛋白的非特异性结合,或者让冷探针优先反应。然后加入标记好的探针,混匀,室温(25℃)放置50min。
4.上样电泳
用0.5X TBE作为电泳液,按照80V的电压预电泳10min;加入EMSA/Gel-Shift上样缓冲液,混匀后立即上样。80V的电压电泳,胶的温度不超过30℃,电泳至EMSA/Gel-Shift上样缓冲液中的蓝色染料溴酚蓝至胶的下缘1/4处,停止电泳。
5.凝胶显影
转膜,紫外交联,封闭,抗体孵育,洗涤曝光,化学发光成像系统曝光成像(曝光时间的长短可以根据检测方法不同而进行相应调整)。
05、文献分享
文献1:
2024年三月发表在《New Phytol》期刊上题为“MYC2 regulates stomatal density and water use efficiency via targeting EPF2/EPFL4/EPFL9 in poplar”的文章,研究者基于三倍体杨转录组数据和三基因互作算法构建网络,发现PpnMYC2与气孔发育相关基因PpnEPF2、PpnEPFL4和PpnEPFL9相关。并且通过EMSA 实验确定了 PpnMYC2 是否可以在体外直接与 PagEPF2、PagEPFL4 和 PagEPFL9 启动子结合,如下图1(c-e)所示,PpnMYC2 特异性结合到含有正常 CACGTG 和 CATGTG 序列的启动子片段上。
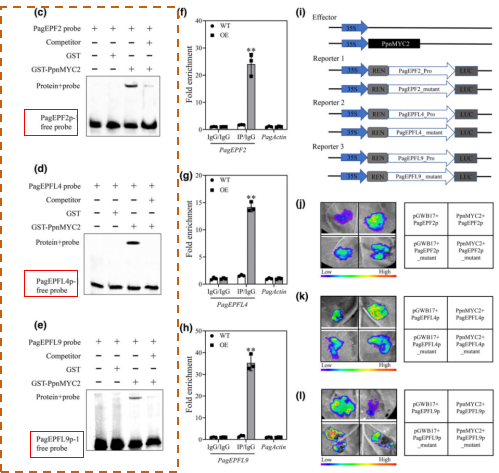
图1. PpnMYC2 直接与 PagEPF2、PagEPFL4 和 PagEPFL9 启动子结合。 c-e:EMSA实验,第一泳道只含标记探针(probe),第二泳道含probe和标签蛋白GST,第三泳道含probe和PpnMYC2-GST,第四泳道含probe、PpnMYC2-GST和竞争探针(compititor);F-H ChIP-qPCR实验;i-L双荧光素酶实验。
文献2:
这是去年发表在《STAR Protoc》期刊上题为“Electrophoretic mobility shift assays (EMSAs) for in vitro detection of protein-nucleic acid interactions”的文章,作者提出了一种在体外检测蛋白质-DNA 或蛋白质-RNA 相互作用的方案,描述了标记核酸种类和电泳迁移率变化测定(EMSA) 的步骤。该方案可用于使用重组表达/纯化的目标蛋白质和核酸底物确认可疑的体内相互作用,它还可以进一步用于研究可能破坏相互作用的突变或恢复相互作用的代偿性突变。
EMSA作为分子生物学经典工具,持续为生命科学基础研究及转化应用提供关键证据链,是解析基因表达“开关”机制的利器,武汉金开瑞能够提供包括EMSA、双荧光素酶、酵母双杂等10余种分子互作技术服务,从方案流程设计到技术试验执行,从科研技术服务到成品试剂盒提供,金开瑞实验平台满足您的一切需求,期待与您一起携手合作。
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










