J Nanobiotechnology | 叶酸修饰的生姜衍生的细胞外囊泡可以重塑免疫微环境,靶向治疗类风湿性关节炎
类风湿关节炎(RA)作为一种高发的自身免疫性疾病,以持续性滑膜炎症和关节功能障碍为特征,现有疗法(如非甾体抗炎药、免疫抑制剂)存在显著副作用和高成本问题。植物来源细胞外囊泡(PEVs)因其来源丰富、成本低、低免疫原性、高生物相容性及易量产等优势成为理想替代方案,其中姜来源细胞外囊泡(GDEVs)天然具有抗炎和免疫调节功能,但缺乏靶向性限制了其在RA病灶的精准递送。
近期发表在《Journal of Nanobiotechnology》上的一篇文章“Folic acid-modified ginger-derived extracellular vesicles for targeted treatment of rheumatoid arthritis by remodeling immune microenvironment via the PI3K-AKT pathway”通过叶酸(FA)修饰GDEVs,构建靶向RA病灶M1巨噬细胞的FA-GDEVs系统,以实现免疫微环境的重塑和RA的高效治疗。
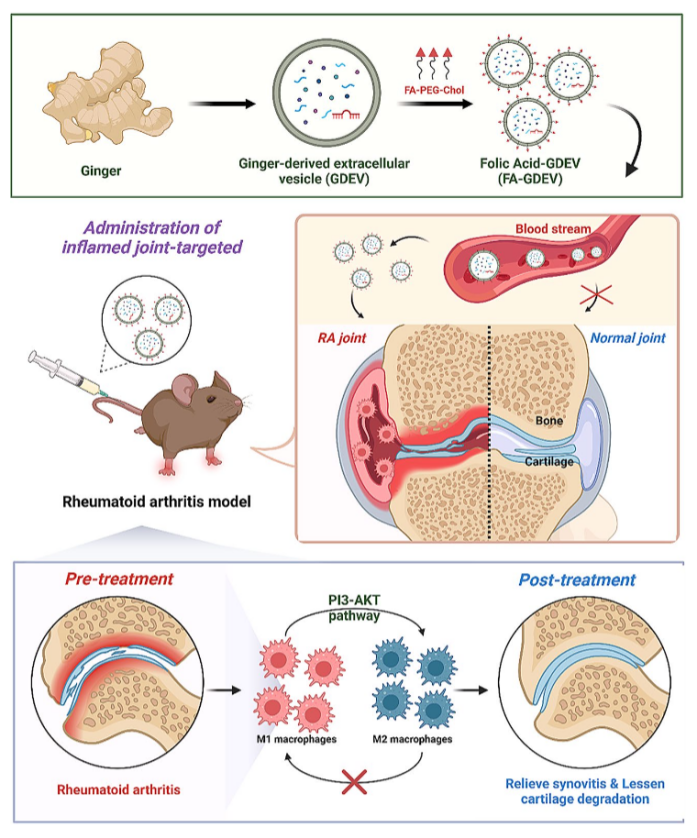
一、研究思路
设计靶向递送系统——体外靶向与机制研究——体内疗效与安全性验证
二、研究方法
01、GDEVs和FA-GDEVs的分离与表征
本研究通过差速离心结合蔗糖密度梯度离心法成功分离姜来源细胞外囊泡(GDEVs),该方法具有高可靠性和重现性;随后通过疏水插入技术将叶酸-聚乙二醇-胆固醇(FA-PEG2000-Chol)以4:1质量比修饰GDEVs构建FA-GDEVs,表征显示其粒径分布峰值增至268 nm,Zeta电位由-26.57 mV升至-22.63 mV,透射电镜证实其保持典型脂质双层囊泡结构,高效液相色谱检测到关键抗炎成分6-姜酚(148.87 μg/mg)和6-姜烯酚(20.38 μg/mg)在修饰后仍有效保留,证明该修饰工艺未破坏GDEVs的物理稳定性和生物活性,为后续靶向递送奠定了坚实基础。
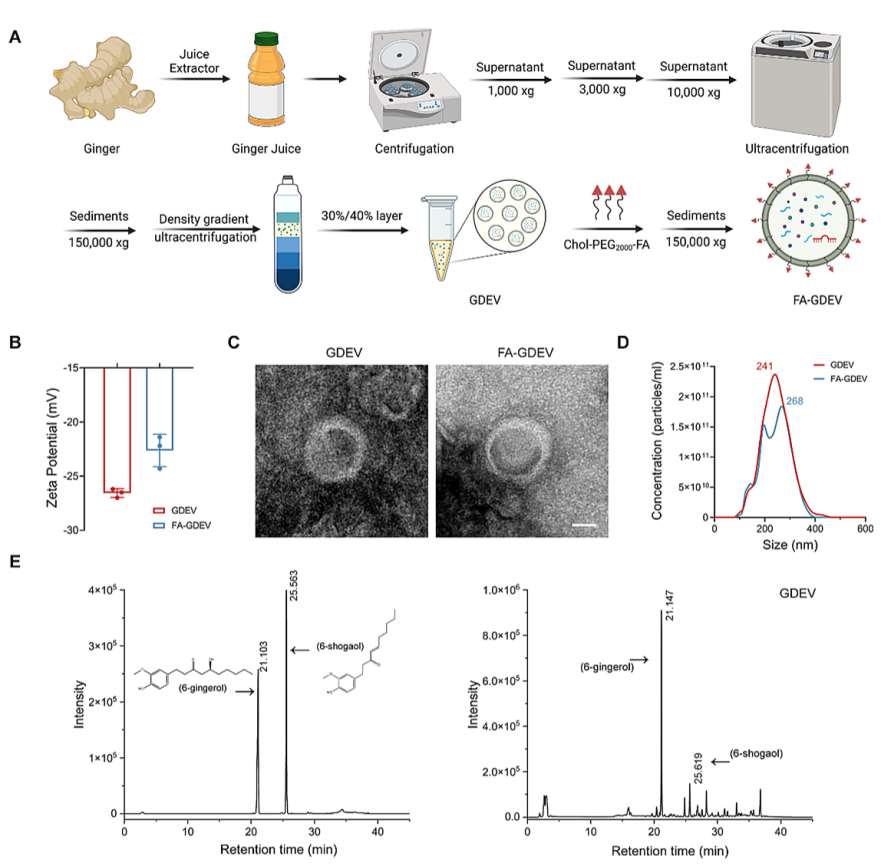
图1: GDEVs和FA-GDEVs的分离与表征
(A) 从生姜中提取的GDEVs示意图及通过将FA-PEG2000-Chol与GDEV偶联制备FA-GDEVs;(B) GDEVs和FA-GDEVs的Zeta电位;(C) GDEVs和FA-GDEVs的代表性TEM图像;(D) 通过NTA测量的GDEVs和FA-GDEVs的粒径分布及单位体积颗粒数;(E) 通过HPLC确认GDEVs中存在6-姜酚和6-姜烯酚。
02、FA-GDEVs的体外与体内靶向递送
体外实验证实,FA-GDEVs通过叶酸受体(FR)介导的主动靶向机制,被LPS+IFN-γ激活的M1巨噬细胞高效摄取(荧光显微镜和流式细胞术显示摄取量显著高于未修饰GDEVs),且竞争实验中游离叶酸预处理可减少40.9%的摄取;体内实验进一步表明,尾静脉注射FA-GDEVs后,其在胶原诱导关节炎(CIA)小鼠关节中的荧光信号随时间增强(12小时达峰并持续24小时),显著高于GDEVs组,且免疫荧光显示FA-GDEVs与关节中叶酸受体(FOLR2)高度共定位,证明其精准靶向病灶M1巨噬细胞的能力。同时,两种囊泡在150 μg/mL浓度下均无显著细胞毒性,为后续治疗奠定安全基础。
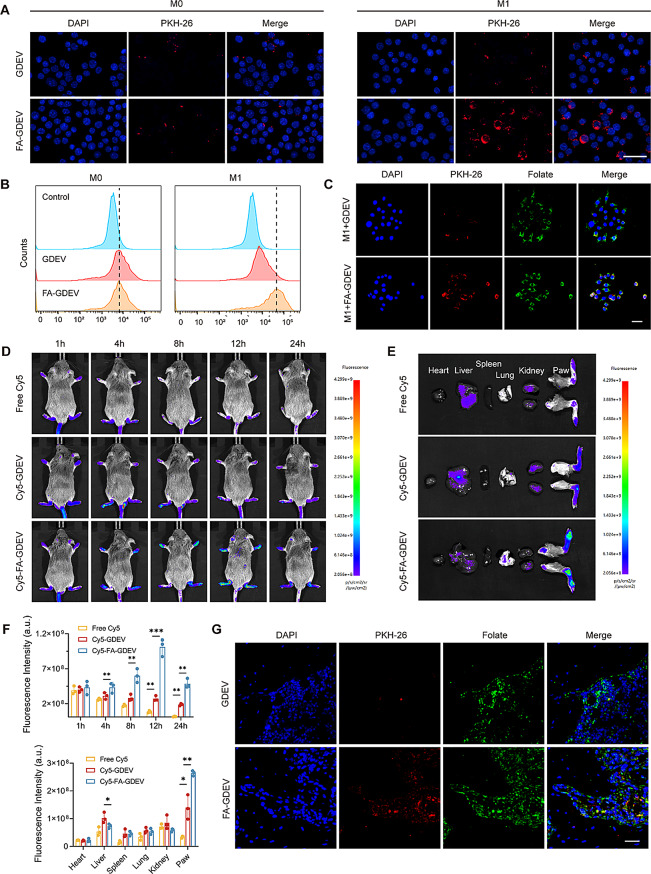
图2:FA-GDEVs的体外及体内靶向递送
(A) BMDMs中GDEVs和FA-GDEVs的细胞摄取行为;(B) 采用流式细胞术测定BMDMs内PKH26染色的GDEVs和FA-GDEVs的荧光强度。(C) 荧光显微镜显示细胞核(蓝色)、PKH26标记的GDEVs和FA-GDEVs(红色)与叶酸受体(FRs,绿色)的共定位;(D) CIA小鼠模型中游离Cy5、Cy5染色的GDEVs和FA-GDEVs的全身荧光成像;(E) 游离Cy5、Cy5染色的GDEVs和FA-GDEVs的离体器官分布图像;(F) 注射Cy5、GDEVs和FA-GDEVs的CIA小鼠全身荧光强度及其时间变化的定量分析,以及爪子和主要器官中的荧光强度;(G) CIA小鼠炎症关节滑膜中GDEVs和FA-GDEVs与FRs的共定位。
03、FA-GDEVs诱导的体外巨噬细胞极化
通过LPS+IFN-γ诱导骨髓来源巨噬细胞(BMDMs)向促炎M1型极化后,FA-GDEVs处理显著降低M1标志物(iNOS、TNF-α、IL-6)的表达,同时上调M2标志物(CD206、Arg-1、IL-10),且效果优于未修饰GDEVs及游离6-姜酚/6-姜烯酚。流式细胞术显示iNOS阳性细胞比例从53.7%降至12.4%,CD206阳性细胞比例从0.61%升至62.3%;免疫荧光与Western blot进一步证实表型转换。机制研究表明,FA-GDEVs通过激活PI3K-AKT通路介导极化,而PI3K抑制剂LY294002可逆转该效应,证实该通路为关键调控机制。
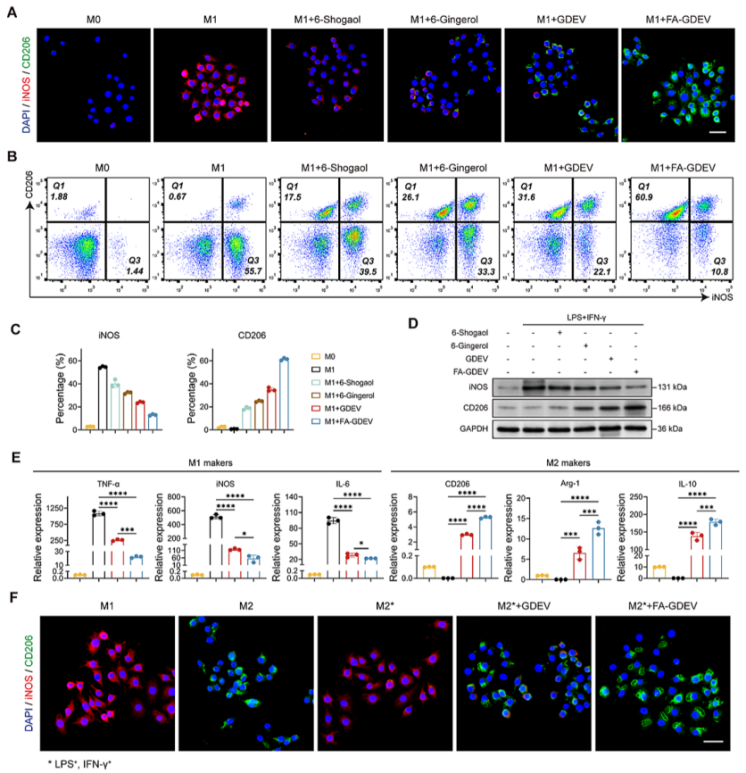
图3:FA-GDEVs诱导巨噬细胞体外极化
(A)不同处理组BMDMs(骨髓来源巨噬细胞)及LPS+IFN-γ活化BMDMs处理48小时后的免疫荧光染色;(B和C)通过流式细胞术分析M1和M2型标志物的比率(B)及定量(C);(D)iNOS和CD206的蛋白水平;(E)M1和M2型巨噬细胞标志物基因表达水平的qRT-PCR分析;(F)在LPS+IFN-γ存在下,不同处理组处理BMDMs(IL-4+IL-13)48小时后的免疫荧光染色。
04、FA-GDEVs的miRNA谱分析
通过对FA-GDEVs进行miRNA测序,发现其保留了丰富的姜源性miRNA,且修饰过程未显著改变miRNA谱;进一步筛选出5个具有免疫调节潜能的人源miRNA(如miR-22-3p、miR-143-3p等),通过GO/KEGG富集分析证实这些miRNA主要参与调控PI3K-AKT通路,该通路在巨噬细胞M1向M2表型转换中发挥关键作用,为FA-GDEVs重塑免疫微环境的分子机制奠定理论基础。
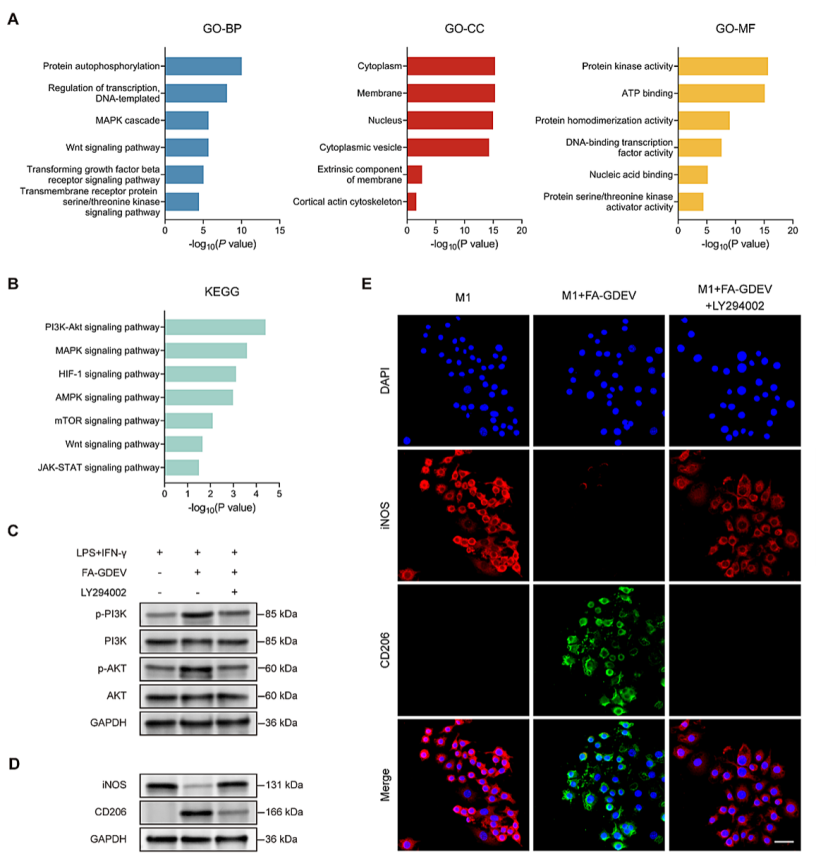
图4: FA-GDEVs的miRNA分析(A和B)GO(A)和KEGG(B)分析。展示了在GDEVs和FA-GDEVs的预测靶基因中显著富集的术语;(C和D)p-PI3K、PI3K、p-AKT、AKT的蛋白质印迹法结果,(C)展示了经不同实验组处理的LPS和IFN-γ刺激的骨髓来源巨噬细胞(BMDMs)中iNOS和CD206的水平,(D)呈现了其他蛋白质的水平;(E)不同实验组处理48小时后,LPS+IFN-γ活化的BMDMs的免疫荧光染色。
05、FA-GDEVs在胶原诱导关节炎(CIA)小鼠模型中的体内治疗效果
在胶原诱导关节炎(CIA)小鼠模型中,静脉注射FA-GDEVs(1.5 mg/kg,每三天1次,共7次)显著优于未修饰GDEVs和阳性对照药物甲氨蝶呤(MTX)。具体表现为:
❖关节症状改善:FA-GDEVs组关节肿胀程度最低(临床评分和爪厚度显著降低),且关节炎症细胞浸润、滑膜增生及软骨破坏(H&E、SOFG、TB染色)最接近野生型小鼠水平;
❖免疫调节:显著降低血清促炎因子(TNF-α、IL-6、IL-1β),同时促进M1型巨噬细胞向M2型极化(关节组织iNOS↓/CD206↑);
❖骨修复:减少破骨细胞生成(TRAP染色),并通过微CT重建显示关节骨侵蚀明显减轻(BV/TV↑、Tb.Th↑、BS/BV↓),骨微结构接近正常;
总的来说,这些发现表明 FA-GDEV 在治疗 RA 方面具有相当大的治疗潜力。
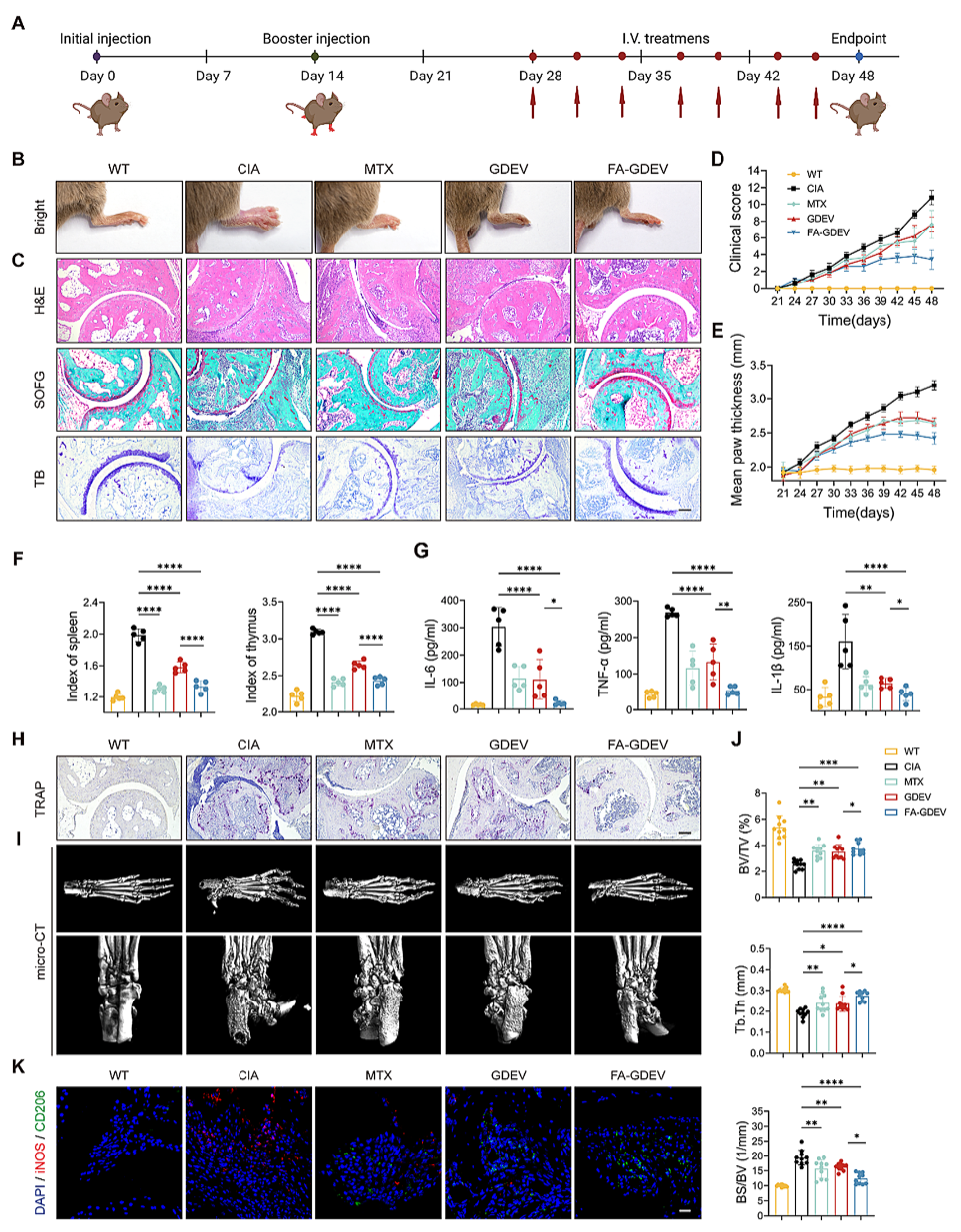
图5:FA-GDEVs在CIA小鼠体内的治疗效果
(A)RA治疗方案示意图;(B)不同治疗组小鼠实验结束时的后肢代表性图像;(C)踝关节的H&E染色、SOFG染色和TB染色图像;(D和E)每三天记录小鼠的关节炎临床视觉评分(D)和爪厚测量值(E);(F)不同治疗组小鼠的脾脏和胸腺指数;(G)通过ELISA测定血清中促炎细胞因子水平;(H)小鼠踝关节中TRAP染色破骨细胞的水平;(I)小鼠踝关节后外侧的代表性micro-CT图像;(J)踝关节的BV/TV、BS/BV和Tb.Th定量micro-CT分析;(K)踝关节的免疫荧光染色。
06、FA-GDEVs的体内安全性评估
通过H&E染色对小鼠主要器官(心、肝、脾、肺、肾)的组织学分析显示,FA-GDEVs治疗未引起任何明显的病理损伤或毒性反应;溶血实验进一步证实其静脉给药无溶血效应;此外,FA-GDEVs治疗显著缓解了RA模型小鼠的体重减轻现象,表明其具有良好的生物相容性和体内安全性。

图6:FA-GDEVs的体内毒性实验
(A)各处理组主要器官的H&E染色图像;
(B)各处理组的溶血率及代表性图像;
(C)各处理组的体重变化。
三、研究结论
本研究通过开发靶向活化巨噬细胞的姜来源细胞外囊泡(GDEVs),即叶酸修饰的FA-GDEVs,为类风湿关节炎(RA)治疗提出了一种创新策略。作为高效天然免疫调节剂,FA-GDEVs在RA小鼠模型中展现出显著缓解症状的潜力。其核心治疗机制在于通过PI3K-AKT信号通路调控M1巨噬细胞极化,促进其向抗炎的M2表型转化。
本研究首次系统阐明了GDEVs在RA治疗中的功能机制,该调控机制不仅限于RA,有望扩展至其他涉及巨噬细胞异常活化的疾病领域。FA-GDEVs作为一种新型生物活性载体,凸显了植物源性细胞外囊泡在免疫调节治疗中的重要价值和广阔前景,为未来相关研究与临床转化提供了有希望的路径。
文献来源:Han R, Zhou D, Ji N, Yin Z, Wang J, Zhang Q, Zhang H, Liu J, Liu X, Liu H, Han Q, Su J. Folic acid-modified ginger-derived extracellular vesicles for targeted treatment of rheumatoid arthritis by remodeling immune microenvironment via the PI3K-AKT pathway. J Nanobiotechnology. 2025 Jan 23;23(1):41.
最新动态
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图
-
12.10
RNA-蛋白互作研究全景解析:从circPOLR2A案例看机制探索之路
-
12.10
神奇的“植物外泌体”?铁皮石斛衍生的纳米囊泡登顶顶刊,揭示皮肤再生新密码!
-
11.20
Journal of Pharmaceutical Analysis | 生姜外泌体作为姜黄素递送系统在治疗溃疡性结肠炎中的应用
-
11.20
J Nanobiotechnology | 叶酸修饰的生姜衍生的细胞外囊泡可以重塑免疫微环境,靶向治疗类风湿性关节炎
-
11.20
WB实验翻车无数次?可能从一开始,你的抗体就选错了!
-
11.20
从“核心”到“网络”:如何以已知基因为锚点,绘制其上下游通路图谱!










