Materials Today Bio(IF:10.2)| 载有西兰花外泌体的抗菌水凝胶可促进 MRSA 感染伤口的抗疤痕愈合
耐甲氧西林金黄色葡萄球菌(MRSA)感染伤口的治疗面临两大难题:抗生素耐药性导致的感染控制失败,以及持续炎症引发的组织修复障碍。传统疗法难以动态调控以巨噬细胞为核心的免疫微环境,易导致瘢痕过度形成或二次感染。
近年来,植物来源的外泌体因其低免疫原性、易规模化生产和跨物种调控能力,成为组织修复领域的研究热点。西兰花外泌体(Bro-Exos)含有天然抗炎与促修复成分,具有良好的生物安全性,但其在感染伤口中的协同“抗炎-再生”时序调控机制尚未明确。
今年9月5号刚发表在《Materials Today Bio》期刊上的一篇题为“Antimicrobial hydrogel loaded with broccoli exosomes promotes anti-scarring healing of MRSA-infected wounds”的文章,该研究创新性地构建了一种光交联复合水凝胶材料 SK@E-Au@Exos,集成以下三大功能模块:丝素蛋白甲基丙烯酰水凝胶(SK):作为载体,具备良好生物相容性与光交联可控释放能力;表没食子儿茶素没食子酸金-金纳米颗粒(E-Au NPs):通过光热效应高效杀灭MRSA与大肠杆菌;西兰花外泌体(Bro-Exos):调控巨噬细胞从M1促炎表型向M2抗炎/修复表型转变,抑制NF-κB通路,促进组织再生。该材料实现了“抗菌-抗炎-再生”的时序性调控,在感染控制的同时促进无疤愈合。这为耐药菌感染伤口的临床治疗提供了一种创新策略,结合了抗菌和再生功能。

一、主要研究思路
1、Bro-Exos的提取、表征和摄取
通过差速超速离心成功从西兰花中提取出外泌体,TEM显示其为典型的杯状结构,NTA测得其粒径约120 nm,WB验证其高表达外泌体标志蛋白(CD63、CD9、TSG101)(图1A-C)。细胞摄取实验表明,Bro-Exos能被巨噬细胞和成纤维细胞有效内吞,预示其具有生物学功能(图1D)。将Bro-Exos加载到SK@E-Au水凝胶中,场发射扫描电镜直接观察到外泌体被封装在水凝胶中,水凝胶的形状仍然是圆形的,直径没有明显变化(图1E)。荧光显微镜还显示,PKH26标记的外泌体均匀分布在内部,证实了外泌体成功加载到水凝胶中(图1E)。随后,通过水凝胶降解试验检测外泌体的释放浓度,发现外泌体可以缓慢释放,并持续7 d以上(图1G)。

图1. Bro-Exos 的提取、鉴定和摄取
2、水凝胶的制备、表征和效果评估
对复合材料各组分(E-Au NPs, SK水凝胶)进行物理化学性质表征,FT-IR光谱中-OH与C=O吸收峰的位移(图2A),这些变化表明羧基和羟基可能在E-Au纳米颗粒的合成和稳定中发挥作用。TEM与DLS显示其为分布均匀的球形颗粒,平均粒径约68 nm(图2B-C);流变学测试表明E-Au NPs的加入增强了水凝胶的机械稳定性(图2D)。SK@E-Au及其复合水凝胶在近红外激光照射下表现出显著的光热效应(5分钟内升温约33°C),而纯SK水凝胶无此性能(图2E)。水凝胶前驱体液体在紫外照射前具有良好的流动性; 此时液面不随小瓶倾斜而变化,保持平行于水平面。经过一定时间的紫外照射后,都能快速形成稳定的水凝胶该体系还具备光触发快速凝胶的能力,便于临床应用(图2F)。SEM进一步观察了水凝胶的微观形貌,显示所有水凝胶均具有连通的多孔结构,有利于细胞生长和药物缓释(图2G)。除此之外还发现,该水凝胶对MRSA和大肠杆菌具有极高的抑菌率(均>94%)。 Live/Dead染色及长期体内实验表明,材料无细胞毒性,且对主要脏器无损伤,生物相容性优异。这些结果共同验证了E-Au NPs的成功合成、水凝胶的理想物理结构及其优异的光热转换能力,为后续的抗菌与再生功能奠定了坚实的材料学基础。
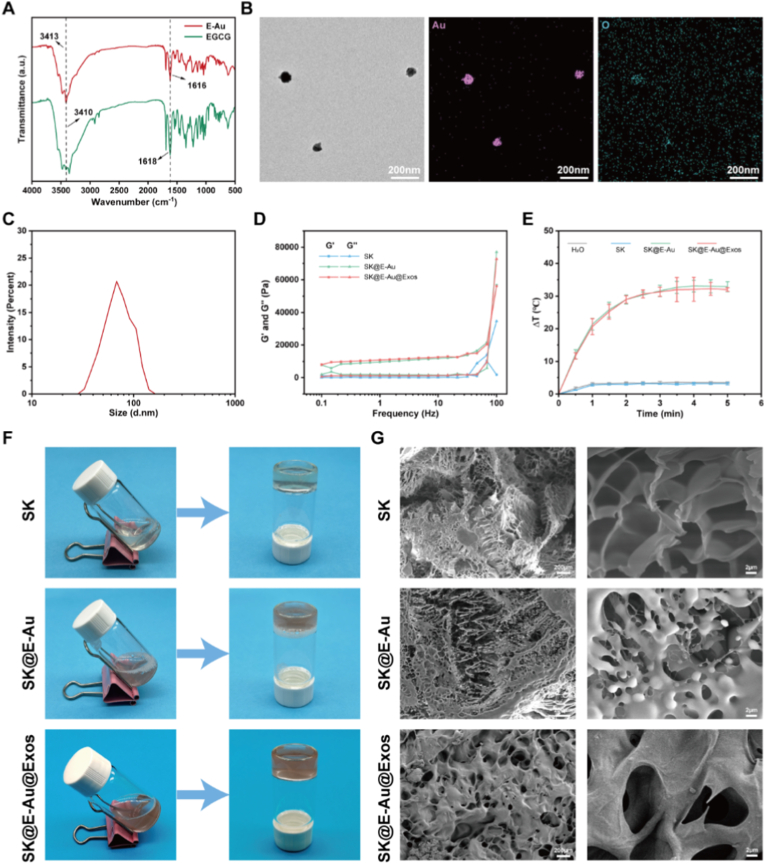
图2. 水凝胶的表征
3、SK@E-Au@Exos载体的功能验证
在体外验证材料的促修复能力,EdU实验和划痕实验表明,该材料能显著促进人脐静脉内皮细胞(HUVEC)和成纤维细胞(L929)的增殖与迁移,有效促进血管网络形成,为后续血管化奠定基础。通过免疫荧光和ELISA实验研究了SK@E-Au@Exos的ROS清除和炎症能力逆转,发现该材料能有效清除活性氧(ROS),清除效率达42.8%。同时,它能驱动巨噬细胞由促炎的M1表型向抗炎的M2表型极化,并上调抗炎因子IL-10的表达。表明,SK@E-Au@Exos具有通过免疫微环境调节协同促进组织再生的潜力。
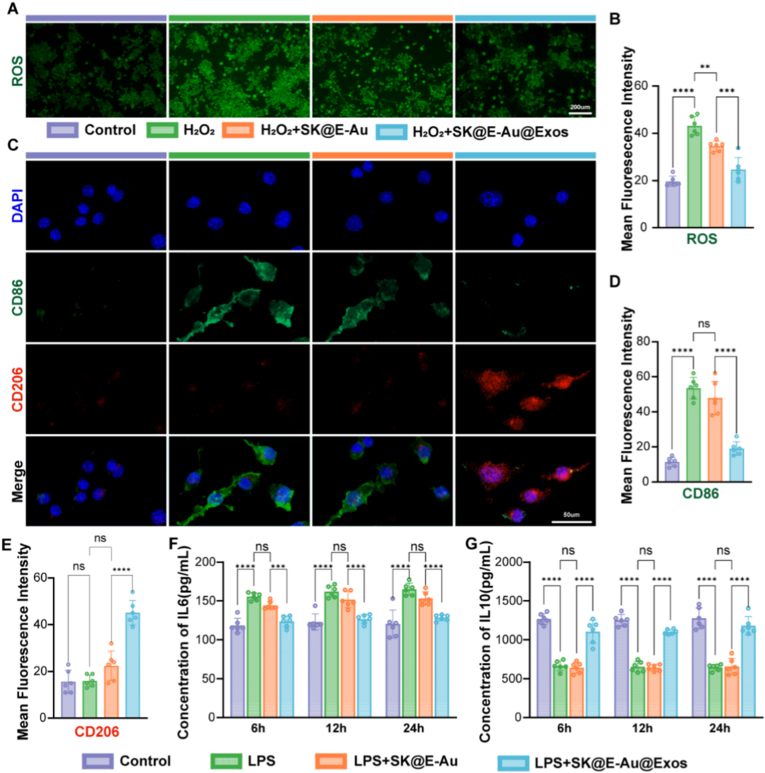
图3. SK@E-Au@Exos清除 ROS 并逆转炎症
为了从基因层面揭示免疫调控的分子机制,通过mRNA-seq分析发现,材料处理导致大量基因差异表达。GO和KEGG富集分析表明,这些基因显著富集于炎症反应、氧化应激应答及NF-κB信号通路。WB实验进一步证实其能抑制NF-κB通路关键蛋白P65和P50的表达,这与体外巨噬细胞表型测定结果一致。SK@E-Au@Exos被证实可以通过抑制NF-κB等途径来重编程巨噬细胞并驱动M2极化,这为植物外泌体调节免疫微环境提供了机制基础。
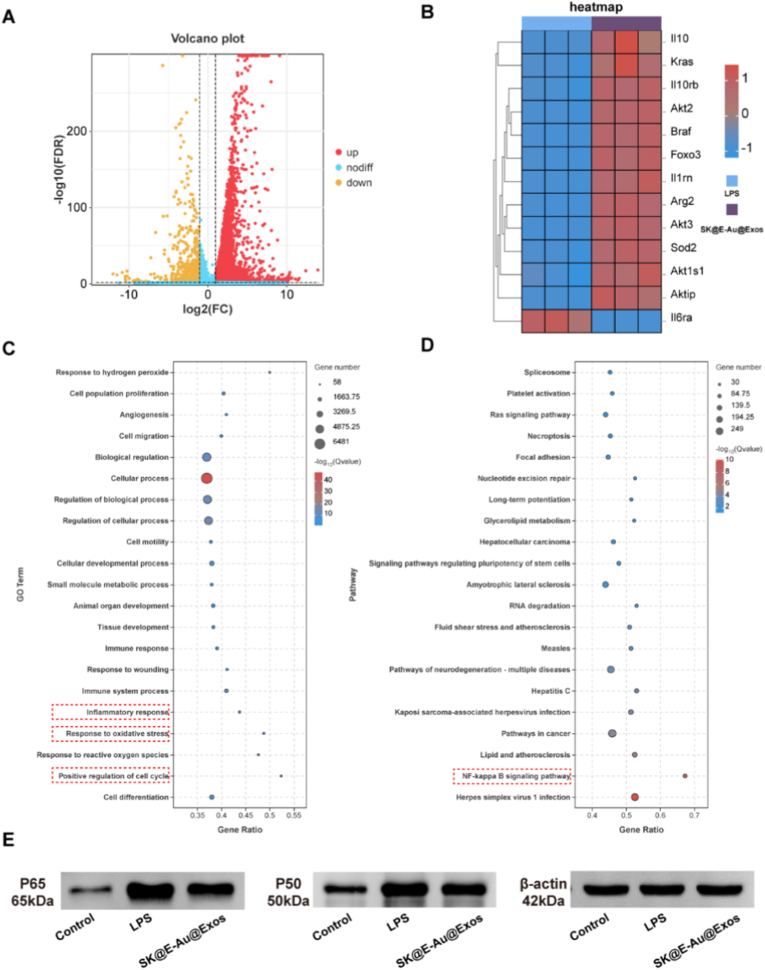
图4. SK@E-Au@Exos重编程巨噬细胞
4、动物模型验证
在小鼠MRSA感染伤口模型中,SK@E-Au@Exos治疗组在第3天就控制住感染,并显著加速伤口闭合(第7天愈合率76.9% vs 37.6%),至第14天基本完全愈合且无肉眼可见疤痕,并伴有新生毛发。H&E染色显示治疗组炎症细胞浸润显著减少,表皮厚度更接近正常皮肤,瘢痕指数大幅降低。Masson染色表明治疗组胶原体积分数(CVF)更高(53.4%),且胶原纤维排列更有序,这是实现无疤愈合的关键证据。
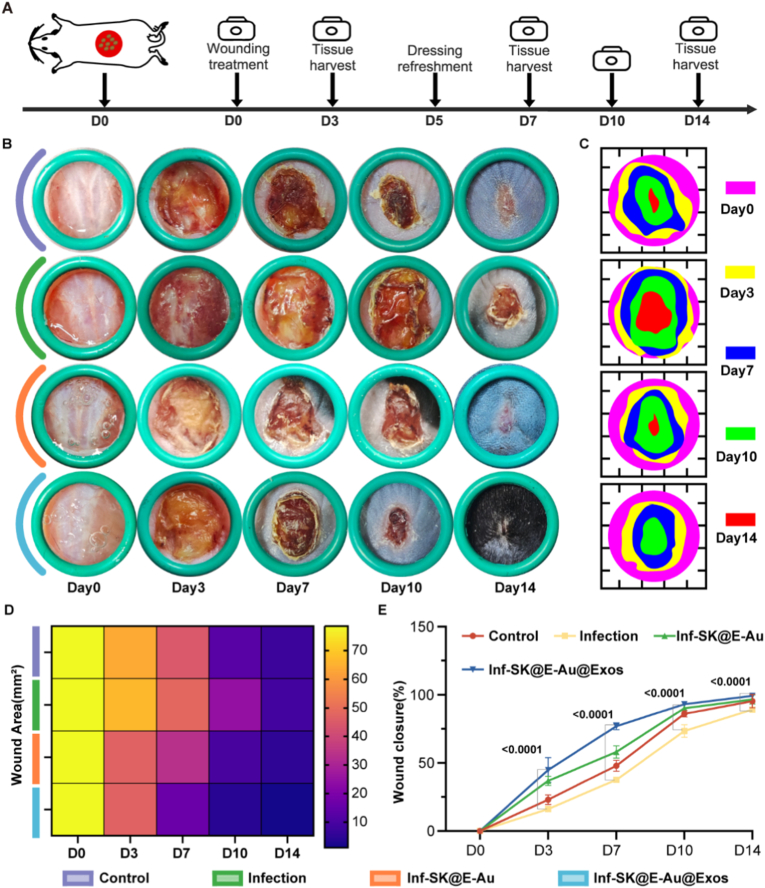
图5. SK@E-Au@Exos促进 MRSA 感染伤口的愈合
通过免疫荧光染色分析MRSA感染创面微环境中ROS、巨噬细胞表型和炎症因子的表达,发现Inf-SK@E-Au@Exos组伤口局部表现出强大的ROS清除能力(清除率51.4%),促进M2型巨噬细胞极化,并显著提高了巨噬细胞M2/M1的表型比率,同时上调促修复因子TGF-β、下调促炎因子TNF-α,与体外实验结果相互印证。KI67免疫组化显示治疗组表皮基底细胞增殖活性显著增强。CD31/α-SMA共染色及Pearson共定位分析表明,治疗组可以促进创面快速再上皮化,逆转MRSA感染引起的血管结构破坏,改善血管成熟,从而达到促进感染创面抗瘢痕愈合的效果。
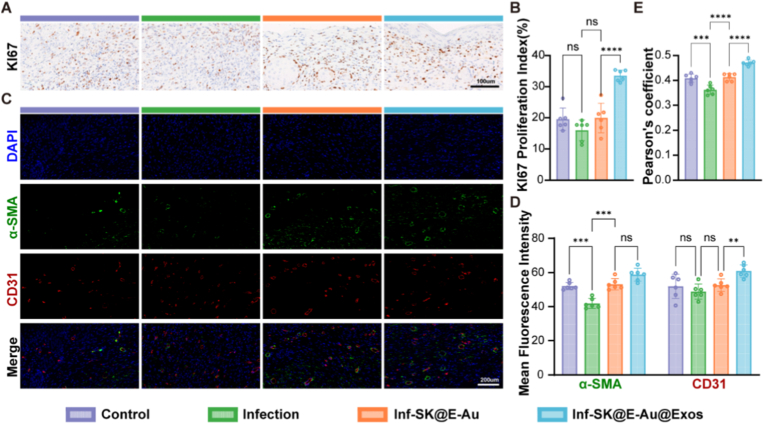
图6. SK@E-Au@Exos促进血管化和再上皮化
本研究首次将西兰花外泌体与E-Au NPs装载于水凝胶中,实现了对MRSA感染伤口的“抗菌-抗炎-再生”全程时序调控。其核心机制在于通过Bro-Exos调控巨噬细胞极化,抑制NF-κB通路,协同E-Au NPs的光热杀菌作用,最终促成高质量无疤愈合。
该策略不仅为耐药菌感染伤口提供了兼具抗菌与促修复功能的治疗新方案,也为植物外泌体的跨物种应用奠定了理论基础。未来研究方向可包括:
❖解析Bro-Exos中关键活性分子(如miRNA、代谢物);
❖开发ROS/pH响应型智能水凝胶以实现更精准的时空控释;
❖推进大动物实验与临床前研究。
文献信息:Duan X, Li J, Gao R, et al. Antimicrobial hydrogel loaded with broccoli exosomes promotes anti-scarring healing of MRSA-infected wounds. Materials Today Bio. 2025;35:102276.
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










