表观研究双雄:ChIP-seq和CUT&Tag,谁更适合你?
“DNA-蛋白质的相互作用是基因调控的核心,而捕获这些互作关系,是解码生命奥秘的关键一步。”从经典的ChIP-seq到新兴的CUT&Tag,表观遗传研究的技术迭代从未停止。今天,我们从原理、数据、成本、样本兼容性四大维度,为你客观解析两大技术的选择逻辑!
一、技术原理
1、ChIP-seq:经典的 “金标准“技术
ChIP-seq全称染色质免疫共沉淀测序(Chromatin Immunoprecipitation with high - throughput sequencing) ,自 1983 年 James Broach 首次公布染色质免疫共沉淀(ChIP)技术以来,经过不断发展,结合高通量测序技术,已然成为该领域研究的 “金标准” 技术。
核心步骤:
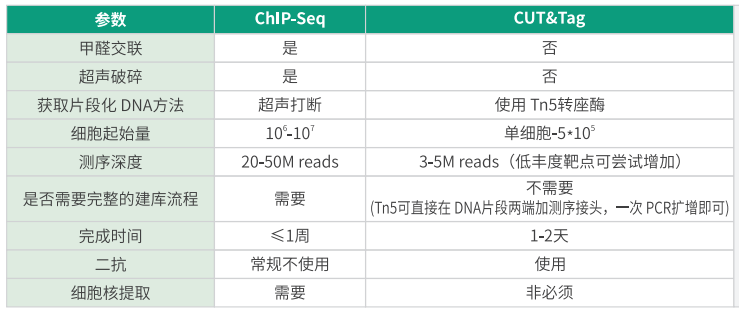
✅ 甲醛交联固定蛋白-DNA复合物
✅ 超声破碎染色质(200-500 bp片段)
✅ 抗体免疫沉淀目标蛋白结合的DNA
✅ 解交联并纯化DNA→建库测序
痛点:
▶ 超声可能导致表位破坏(尤其脆弱复合物)
▶ 交联可能引入非特异性结合背景
2、CUT&Tag:新兴的高效技术
CUT&Tag,即靶向切割及转座酶技术(Cleavage Under Targets and Tagmentation) ,是 2019 年由 Steven Henikoff 团队创新性开发的技术。
核心步骤:
✅ 活细胞操作:抗体穿透细胞膜结合目标蛋白
✅ Tn5酶定向切割:融合Protein A/G的Tn5酶定位抗体,切割并标记邻近DNA
✅ “原位”建库:无需染色质破碎与免疫沉淀
优势:
▶ 背景噪声降低(信噪比提升10倍以上)
▶ 保留天然染色质状态
从原理上看,二者都依赖特异性抗体来识别目标蛋白质,但在具体操作流程上有着显著差异。ChIP-seq 需要经过交联、超声破碎等多个步骤,而 CUT&Tag 则巧妙地利用转座酶,在原位实现 DNA 的切割和接头的添加,大大简化了实验流程 。
二、性能对决:用数据说话!
ChIP-Seq 的劣势:
(1)首先,ChIP 需要较多的细胞量,免疫共沉淀需要足够的靶标蛋白,而靶标蛋白有限的情况下就需要提供大量的细胞;
(2)其次,信噪比低,很多转录因子和染色体的结合相对松散,需要甲醛强交联,以防止后续洗涤过程破坏这些结合,这样导致很多非特异性信号,需要更高的数据量得到真实 peak 值;
(3)此外,实验的打断条件、重复性差等都需要系统的摸索才能得到较好的结果。这些因素综合起来导致 ChIP 对新手非常不友好,需要采购特定的设备、很长时间的预实验才能得到满意的结果。
CUT&Tag 技术,它免去了甲醛交联、超声破碎和免疫共沉淀的过程,这样既节省了初始实验材料又提高了信噪比、提升了实验可重复性。
三、样本适用性的差异
1、ChIP-seq:对样本量要求较高
由于 ChIP-seq 实验过程中涉及多个样本损失的步骤,如超声破碎、免疫共沉淀等,因此需要较多的起始细胞量,一般需要百万级别的细胞 。对于一些容易获取大量细胞的样本,如常见的细胞系,ChIP-seq 能够很好地发挥作用。然而,对于一些稀有细胞类型,如胚胎细胞、原代细胞等,由于获取大量细胞较为困难,使用 ChIP-seq 可能会面临样本量不足的问题 。此外,ChIP-seq 在物种和靶位点的兼容性上表现较好,对于不同物种的多种蛋白质与 DNA 相互作用研究都有一定的适用性 。
2、CUT&Tag:低起始量样本的福音
CUT&Tag 技术凭借其独特的原理,对样本起始量要求极低,仅需千级甚至单细胞水平的细胞量即可进行实验 。这使得它在研究稀有细胞类型或难以获取大量细胞的样本时具有极大优势。例如,在研究胰岛细胞、干细胞等细胞量稀少但又具有重要研究价值的样本时,CUT&Tag 能够大显身手 。
不过,CUT&Tag 在物种和靶位点的兼容性方面相对 ChIP-seq 稍逊一筹,在某些情况下,可能需要针对不同的样本和靶标进行更细致的实验优化
四、如何选择?四大决策因素
1、预算与周期
预算有限:ChIP-seq(价格相对偏低)
赶时间:CUT&Tag(省去交联/超声/沉淀步骤)
2、考虑样本类型与细胞数量
当研究涉及稀有细胞类型或难以获取大量细胞的样本时(穿刺样本、干细胞类器官),CUT&Tag 的低细胞量需求无疑是最佳选择,能够充分发挥其优势,获取有价值的实验数据 。而对于不那么受限于样本量的研究,如常见细胞系的研究,ChIP-seq 虽然对样本量要求较高,但凭借其成熟的技术体系,也能提供可靠的结果 。
3、依据研究的靶标选择
若研究的目标蛋白有高质量的 ChIP 级抗体可用,且对交联固定的步骤没有特殊顾虑,ChIP-seq 可以作为可靠的方法 。然而,如果抗体资源有限,或者希望避免交联带来的潜在影响,如某些对交联敏感的蛋白质研究,CUT&Tag 则提供了一种更为灵活的替代方案 。
4、针对信噪比和精确度要求
在关注低丰度信号或需要精细定位蛋白质与 DNA 结合位点的研究中,CUT&Tag 以其高效的信号提取和较低的背景噪音,能够提供更精准的数据,是优选技术 。而如果研究允许一定程度的背景信号,并且更重视广泛的基因组覆盖度,ChIP-seq 在较高测序深度的支持下,也可能满足需求 。
五、未来发展:互补而非取代
“ChIP-seq是经久耐用的‘老将’,CUT&Tag是灵活精准的‘新锐’。”
整合应用:
▶ 先用CUT&Tag对大量的样本进行初步筛选,发现潜在的靶点,再用ChIP-seq对这些靶点进行更深入的分析,包括结合位点的精确位置、结合强度、与基因表达的关系等,从而拓展研究的深度和广度,为后续的功能研究和机制探索提供更丰富的数据支持。
▶ 多组学交叉:ATAC-seq + CUT&Tag联用解析“开放染色质-因子结合”动态ChIP-seq 和 CUT&Tag 作为研究蛋白质与 DNA 相互作用的两大重要技术,各自有着独特的优势和适用场景。在实际研究中,我们需要综合考虑实验室条件、样本类型、细胞数量、靶标特性、数据质量要求等多方面因素,审慎选择最适合自己研究的技术 。
金开瑞可以提供ChIP-seq和CUT&Tag、ATAC-seq、技术服务,如有需求,可随时联系我们,期待与您携手合作,共同推动生命科学的发展。
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










