慢病毒构建稳转细胞系原理
慢病毒是一种长期感染宿主细胞的复杂病毒,具有高效的基因转移能力和较低的免疫原性。因此,慢病毒矢量系统在基因转移和细胞治疗中得到广泛应用。其中,慢病毒构建稳转细胞系是一个重要的实验方法,可以实现外源基因的稳定表达和研究。
慢病毒矢量构建
慢病毒矢量是一类由慢病毒genome改造而来的表达载体。经过适当的改造后,慢病毒矢量可以在宿主细胞中稳定表达外源基因。慢病毒矢量通常包括LTR序列、核心包膜蛋白、外膜蛋白、包膜蛋白、反转录酶等功能区域。其中,LTR序列(长末端反转录转录本反向重复序列)是病毒基因组末端的重复序列,具有使病毒基因组整合到宿主细胞DNA中的功能。核心包膜蛋白、外膜蛋白和包膜蛋白则是慢病毒在宿主细胞中进行感染和复制时的关键蛋白质。反转录酶具有将RNA转变为DNA的功能,从而实现病毒基因组的插入。
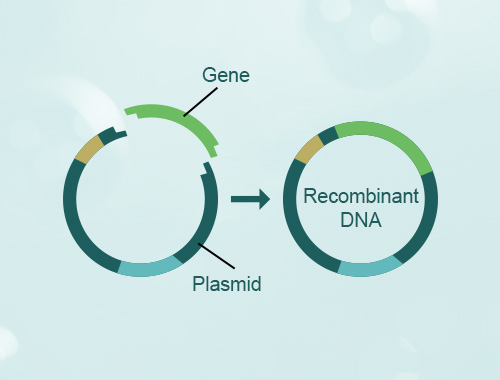
慢病毒构建稳转细胞系原理
构建稳转细胞系的核心是将慢病毒矢量载体导入宿主细胞中,并实现外源基因的稳定表达。其基本流程如下:
构建慢病毒矢量载体:利用分子生物学技术,将需要表达的外源基因克隆到慢病毒载体中,构建成慢病毒表达载体。
质粒转染:将慢病毒表达载体通过质粒转染等方法,导入到封闭式包装细胞中(例如HEK 293T),并加入辅助质粒,启动病毒基因复制和包装。
收集病毒:利用离心、超滤、聚丙烯酰胺凝胶电泳等方法,从培养上清液中收集慢病毒。
稳转细胞系构建:将收集到的慢病毒加入需要稳转表达的细胞(例如293T、Hela等),并培养一定时间。慢病毒在宿主细胞内插入外源基因,并启动外源基因的稳定表达。
筛选和鉴定:利用荧光素酶等方法筛选出转染成功的细胞。通过Western blot、RT-qPCR等方法进一步验证外源基因的表达和稳定性。
慢病毒构建稳转细胞系的优点
与常用的转染方法相比,慢病毒构建稳转细胞系有以下几个优点:
高效性:慢病毒能够将外源基因整合到宿主细胞基因组中,实现稳定的外源基因表达。
特异性:由于慢病毒的感染和复制比较特异,只会影响一定类型的细胞,因此可以实现对具体细胞的选择性转染。
安全性:慢病毒的基因转移速度较缓慢,对宿主细胞和人体的损伤较小,因此具有较高的安全性。
结论
慢病毒构建稳转细胞系是一种重要的实验方法,可以实现外源基因的稳定表达和研究。该方法具有高效、特异性和安全性等优点,已经在生物医学研究领域中得到广泛应用。但注意,实验过程中需严格遵守生物安全规范,控制慢病毒的传播和感染风险。










