酵母双杂交对照实验怎么设计?
酵母双杂交(Y2H)是一种常用的蛋白质相互作用研究方法,用于检测和验证蛋白质间的相互作用关系。在进行酵母双杂交实验时,对照实验是非常重要的,它可以帮助评估实验的可靠性和确定阳性信号。
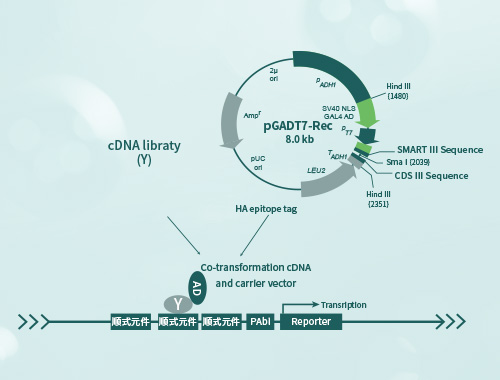
下面是一种常见的酵母双杂交对照实验设计:
阳性对照:选择已知相互作用的蛋白对作为阳性对照。这些蛋白对可以是来自文献报道的、已经被广泛验证的相互作用蛋白对,确保它们能够成功产生可检测的相互作用信号。
阴性对照:选择两个不会相互作用的蛋白作为阴性对照。这些蛋白可以是同一通路上的两个非交互蛋白,或者是从不同通路中选择的蛋白。
控制培养基:设置适当的控制培养基,用于判断实验结果的特异性。在酵母双杂交实验中,通常会使用选择性培养基,包含所需的氨基酸和碱基,以及相应的靶基因报告系统。
质粒转化:将目标蛋白的编码序列克隆到适当的酵母表达质粒中,然后转化到酵母菌株中。确保对照实验和实验组都使用相同的方法进行质粒转化。
鉴定融合蛋白表达:通过酵母菌落PCR或西方印迹等方法验证融合蛋白在酵母中的表达情况。这可以确定酵母菌株中目标蛋白是否正常表达。
β-galactosidase筛选:根据实验设计,在选择性培养基上进行酵母双杂交筛选,观察是否出现相互作用相关的报告系统(如β-galactosidase酶活性)。
通过进行上述对照实验,您可以评估实验的特异性,区分真正的相互作用信号和假阳性结果。同时,正确使用阳性和阴性对照还有助于验证您的实验体系的可靠性和准确性。
在进行酵母双杂交实验时,确保操作严格遵循实验步骤和安全操作规程,并根据实验需求进行相应的优化和控制。

最新动态
-
12.19
CoIP实验如何选择合适的诱饵蛋白抗体?
-
12.18
酵母质粒小提试剂盒与大肠杆菌质粒小提的差异是什么?
-
12.18
合成DNA在引物制备、探针合成、基因芯片制备中的应用分别有哪些?
-
12.18
银染试剂盒适用于哪种凝胶类型?SDS-PAGE凝胶和非变性凝胶的银染操作有区别吗?
-
12.18
引物合成过程中可能产生哪些杂质?如何通过检测手段识别?
-
12.17
CoIP与GST pull-down、酵母双杂交技术相比,优势和局限性分别是什么?
-
12.17
EMSA实验的重复性差,如何从试剂、操作步骤等方面进行优化?
-
12.17
单链DNA(ssDNA)与双链DNA(dsDNA)合成的工艺差异是什么?
-
12.17
双荧光素酶试剂盒的试剂组分通常包含哪些?裂解液的作用机制是什么?
-
12.17
固相合成与液相合成在基因合成中分别有哪些应用?










