染色质免疫沉淀(ChIP)实验分析
信息来源:金开瑞 作者:genecreate 发布时间:2018-12-06 14:01:22
ChIP实验被用来鉴定染色质相关蛋白的定位和/或它们的翻译后修饰状态。这种方法依赖于特异识别目的蛋白或修饰蛋白(例如组蛋白H3 Lys9甲基化)的抗体进行免疫沉淀和分析免疫共沉淀DNA。早期实验方法依赖于使用温和的裂解条件,以保护蛋白质--DNA相互作用,但这种方法只适用于和DNA直接结合的蛋白。甲醛交联方法的使用使得这样的分析可以扩展到与染色质关联的几乎任何蛋白。
非变性、非交联免疫沉淀实验
使用直接和特定DNA结合蛋白结合的抗体从细胞中分离蛋白质--DNA复合物依赖于抽提和免疫沉淀的条件,尤其是在该条件下怎样使蛋白可溶并保持蛋白质-DNA的结合。有几种方法已被成功使用,但是要注意到这一点,要根据蛋白质-DNA复合物所需的条件来调整实验 条件。
该方法本质来说是利用低渗透压裂解细胞,分离细胞核,在低盐条件下使用核酸酶(DNaseI或微球菌核酸酶—Mnase)溶解染色质,接着使用抗体进行免疫沉淀识别目标蛋白。使用多肽可以从免疫复合物中最先洗下蛋白质-DNA复合物,这可以减少在更严格的洗脱下来的,与DNA非特异性结合的蛋白污染。提取的DNA可以克隆用于进一步分析、测序或用于探针阵列分析。
甲醛交联免疫沉淀实验
这已成为研究染色质中动态蛋白质--DNA的强有力方法。甲醛交联的染色质免疫沉淀的实验步骤见图二。甲醛交联使我们能够检测到可能不直接结合DNA的蛋白质--染色质的结合。这种交联方法产生蛋白质-蛋白质、蛋白质-DNA和蛋白质-RNA交联,因此适合于染色质不同成分以及瞬时关联的分析。这也有效地被用于分析染色质翻译后修饰的存在与否。这种方法最初在果蝇体系中是由Varshavski及其同事开发的,由Paro 修正的由两个酵母小组广泛使用和修正的。图二该技术实验步骤适用于所有的ChIP实验,由于研究系统的不同或研究小组的偏好,在实验细节上略有不同。此外,在新研究系统的第一次实验需要优化实验步骤。在下文我们将讨论每一个步骤的一些细节,可能的修改和不同的版本。
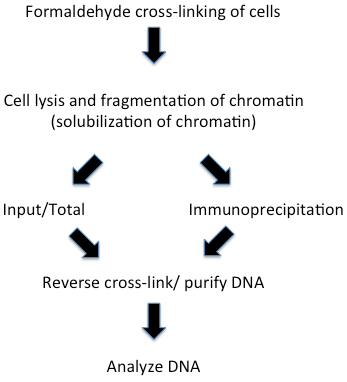
图 1. 甲醛交联和染色质免疫沉淀的纲要步骤
细胞交联实验步骤
有许多种可用于交联反应的化学物质,但是甲醛具有多个优点而被广泛使用。甲醛可溶于水,在大幅度的条件下(缓冲液,温度等)具有活性。最重要的是,它能轻易地穿透生物膜,因此可以在完整细胞中进行交联--这降低了在制备细胞和核提取物时产生复合物重定位的可能性。甲醛可直接加入到细胞生长的培养基中,或任何其他实验材料(例如果蝇胚胎,解剖卵巢等),使其终浓度为1%即可。固定取决于时间和温度,温度越低固定速度越慢。典型的条件是在室温下时不时搅拌15分钟,但时间可以调整为在5分钟至几个小时之间。当希望快速固定时,固定终止是通过加入终浓度为0.125M的甘氨酸。甲醛处理的持续时间由给定的起始材料和目标蛋白的实验情况决定,并且要考虑可溶染色质复原时间以保证不导致目标蛋白免疫学活性的丧失,例如抗原表位被屏蔽、隐藏,以至于不能进行长时间固定。对于那些难以检测的蛋白来说,时间越短,温度越低,甚至甲醛浓度更低可能可以缓解该问题。
| 步骤 | 优化项 | 参数改变 |
| 交联/甲醛 | 通常不需要优化 |
时间:5分钟到几小时 温度: RT - –4 ºC 甲醛浓度:1% - 0.4%。 |
| 细胞裂解 | 通常不需要优化 | 裂解缓冲液选择:SDS-LB; FA-LB;或者其他。 |
| 染色质组分分级 | 依据需要优化 |
超声: 超声仪的选择; 超声持续时间;需要凝胶检测片段大小。 MNase处理:时间和浓度 注意: 组分分级因裂解缓冲液不同而改变;使用特定的裂解缓冲液优化组分分级。 |
| 免疫沉淀 | 依据需要优化 | 抗体选择;抗体孵育时间: 2h-过夜 |
| 解交联/ DNA纯化 | 不需要优化 | 解交联步骤按标准来;纯化: CsCl或者苯酚:氯仿提取;第二种方法更简单并且效率高。 |
| DNA分析 | 根据选择的方法进行优化 | 槽印迹(Slot blots,过时的); PCR; RT-PCR;平铺阵列(Tiling Arrays);二代测序。 |
表.ChIP实验步骤总结
细胞裂解和染色质片段化
细胞裂解和染色质片段化
裂解细胞和获得可溶染色质紧密关联的。依据不同的实验材料对应需要一些额外的实验步骤(例如,酵母 - 机械破损,果蝇胚胎 –去除卵壳)。在培养基和大多数其它物质中生长的细胞需要适当的裂解液重悬细胞和超声处理。甲醛处理过的细胞非常难裂解,因此超声处理这一步不仅需要更有效的裂解并且还需要染色质组分分级。作为超声处理的替代,交联的细胞核可以用微球菌核酸酶部分消化 。目前有两个主要在用的裂解液系统 - SDS-缓冲系统和FA缓冲液。也有其他实验步骤采用些许不同的缓冲液,但是这两种是使用最广的,而且在多个系统中被证明可以很好地使用。对于其他缓冲液,SDS缓冲具有许多优点 – 是超声处理最有效的裂解缓冲液;染色质片段的大小分布变化小;背景少。这个缓冲液包含1%的SDS,在免疫沉淀实验中则需要稀释至0.1%。这个缓冲液条件适用于大多数,但不是所有的抗体。如果缓冲液条件由具体实验决定(见下文),那么这个缓冲液不适合免疫沉淀实验,FA裂解液则是一种很好的替代品。对于超声来说,大多数可重复的结果是由BioRaptor完成的,染色质片段大小平均为∼300 bp 。染色质的片段化是至关重要的,因为片段化程度将影响后续实验的分辨率。稍微有所不同的哺乳动物细胞裂解实验步骤是由Farnham组研发的.
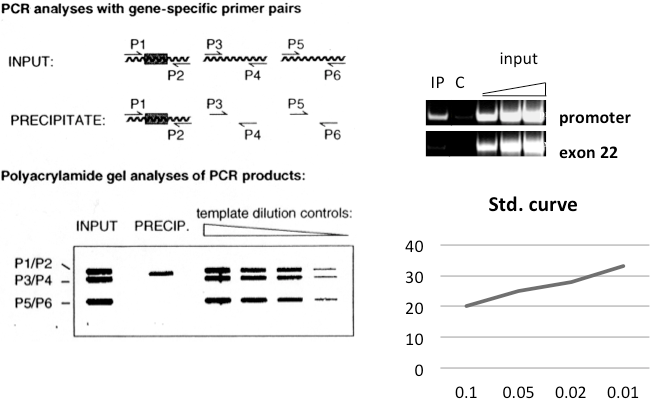
图2. 共沉淀DNA PCR分析
该步骤中的关键因素是抗体选择。如果这个抗体在ChIP实验中没使用过/显示可以使用,采取预实验是非常明智的。请注意,并不是所有公司销售的“ChIP抗体”都可以用来进行ChIP实验。免疫沉淀实验中效果良好的抗体,可能在ChIP实验中并不好用。一些抗体在0.1%SDS的环境下不能很好地发挥功能,而且免疫沉淀实验需要在FA裂解缓冲液的条件下进行。单克隆抗体和合成小肽免疫的抗体可能可以或不可以很好地发挥功能,因为在交联后抗原表位可能被屏蔽了;另一方面,这些抗体具有较高的特异性。一般的多克隆抗体,或者两种或多种单克隆抗体的混合物也是可以尝试的。一旦实验确定该抗体可在交联的条件下进行免疫沉淀,则需要测试在这些条件下的抗体特异性。这可以通过在实际ChIP实验中引入阴性对照(免疫沉淀 RNAi处理的细胞,突变细胞,等等)来实现。如果能测定全基因组,那么结果就是特别真实可靠的。
最新动态
-
09.04
Phytomedicine | 巴戟天衍生的外泌体如何发挥抗骨质疏松作用?
-
09.04
科研小伙伴速来围观!超实用的科研网站
-
09.04
【客户文献分享】Advanced Science(IF=15.6)| Irisin调控ENO1泛素化改善肺动脉高压肺血管重构
-
08.20
Materials Today Bio | 茶叶外泌体让变白变美更简单
-
08.20
DAP-seq:解锁植物转录因子调控密码的高效利器
-
08.20
凝胶迁移实验(EMSA)要点剖析!
-
08.20
小干扰RNA(siRNA)技术的核心
-
08.06
J NANOBIOTECHNOL (IF:12.6) | 白术衍生的细胞外囊泡样颗粒通过重塑肠道微生态平衡促进溃疡性结肠炎的恢复
-
07.30
一文带你全方位解析ChIP技术
-
07.30
双荧光素酶实验-从文献实例看核心应用方向










