关于酵母杂交文库构建及筛选你需要知道这些
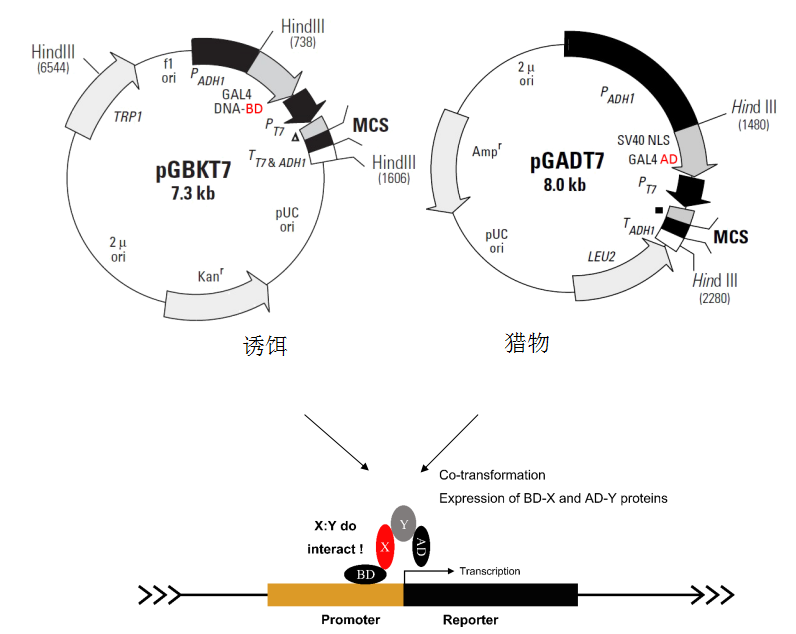
1.Q: 酵母双杂交的筛选流程?
A: 将已知基因作为诱饵,在选定的cDNA文库中筛选与诱饵蛋白相互作用的蛋白,从筛选到的阳性酵母菌株中可以分离得到AD-LIBRARY质粒,对质粒中的cDNA片段进行测序,并对该片段的编码序列在GENEBANK中进行比较,研究与已知基因在生物学功能上的联系。
2. Q: 酵母杂交技术有哪些优势?
A: a.体内的互作验证,省去蛋白表达、纯化等步骤;b. 细胞内验证,在一定程度上反应细胞内的真实情况;c. 可以检测微弱的蛋白互作;d. 可对不同组织、器官、细胞、分化阶段材料进行文库构建和筛选
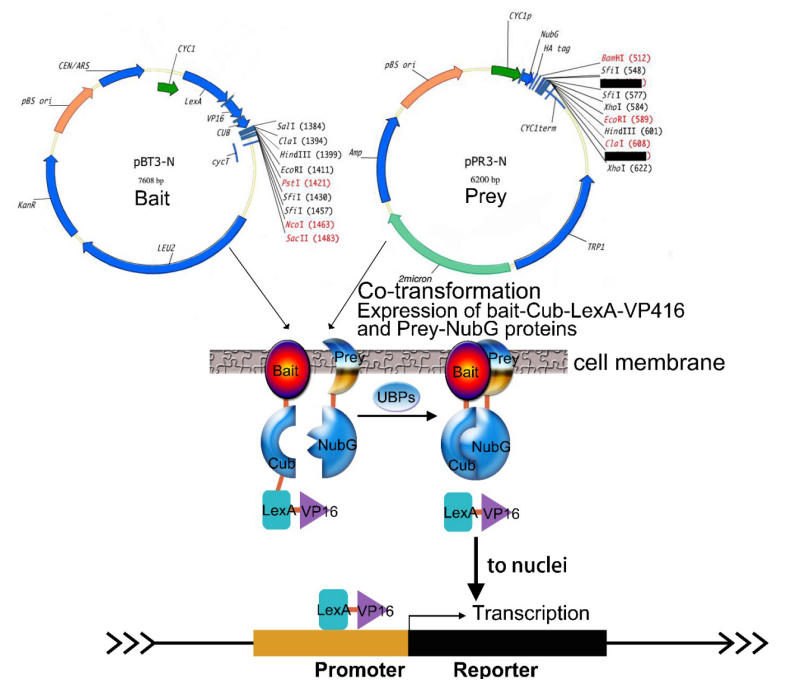
3.Q:如何确定是选择构建核体系文库还是膜体系文库?
A: 如果诱饵基因是定位在膜上的蛋白则选择膜体系文库,如果诱饵基因是定位于核则选择核体系文库,如果诱饵基因有跨膜区也可以考虑把跨膜区切除以后用核体系文库筛库,但是这样操作有一定风险。
4.Q: 如果诱饵蛋白能够直接激活报告基因的表达,改如何处理?
A: 该蛋白很可能是转录因子,具有转录激活域。可以通过基因重组切掉转录激活域,然后重新检测其是否自激活。但是要注意重组也有可能破坏蛋白之间的互作。
5.Q: 杂交效率不高,怎么办?
A: 在杂交中,预转化的诱饵细胞的数量可能不够。当对诱饵菌株进行液体培养过夜时,应挑选大的、新鲜的克隆进行培养,经过离心和重悬后,再使用血球计对细胞进行计数,提高杂交效率。
6.Q: 酵母双杂交出现假阳性的原因?如何解决?
A: 由于BD融合诱饵蛋白有单独激活作用,或者其激活作用被外来蛋白激活。AD融合靶蛋白如果有DNA的特异性结合,则也可单独激活报告基因的表达。因此,需要作严格的对照试验,对诱饵和靶蛋白分别作单独激活报告基因的鉴定,以排除假阳性。也可以采用多个报告基因,且每个报告基因的上游调控区各不相同,这可减少大量的假阳性。另外,报告基因整合到染色体上,可以使基因表达水平稳定,消除了由于质粒拷贝数变化引起基因表达水平波动而造成的假阳性。
7.Q: 酵母双杂交系统有哪些应用?
A: a.发现新的蛋白质和蛋白质的新功能;b. 在细胞体内研究抗原和抗体的相互作用;c. 筛选药物的作用位点;d. 建立基因组蛋白连锁图
8. Q: 金开瑞酵母双杂交有哪些优势?
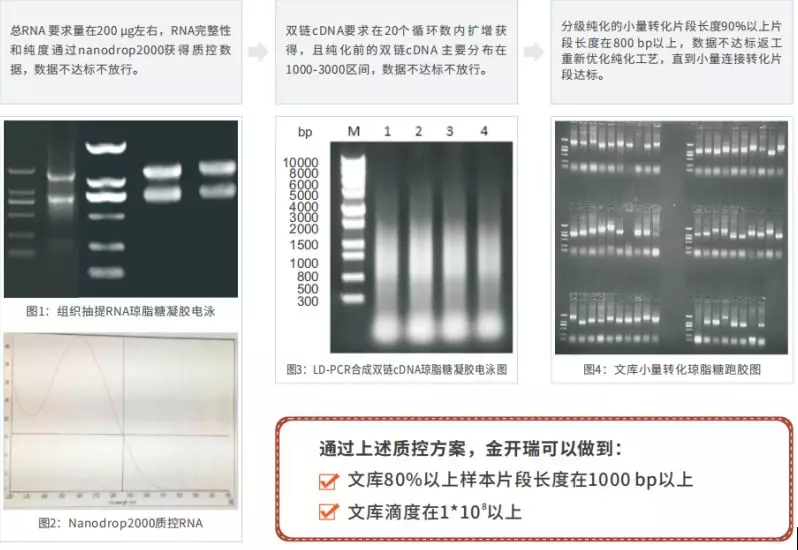
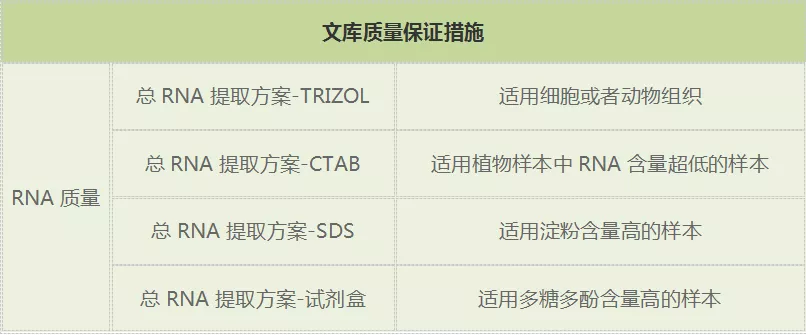
A: a.我们会进行自激活及毒性检测;b. 文库构建,我们采用纯化分离mRNA材料建库,增加了文库样本的有效性,5’端引物设计保证N端序列的有效性;c. 文库容量达标(>1*107cfu/mL)。