原核载体构建和诱导表达实验
信息来源:金开瑞 作者:genecreate 发布时间:2023-08-21 15:26:01
原核载体构建和诱导表达是常用的实验技术,用于将外源基因插入到原核生物(如大肠杆菌等)的载体中,并通过适当的诱导剂使其表达。以下是一般的原核载体构建和诱导表达的步骤:
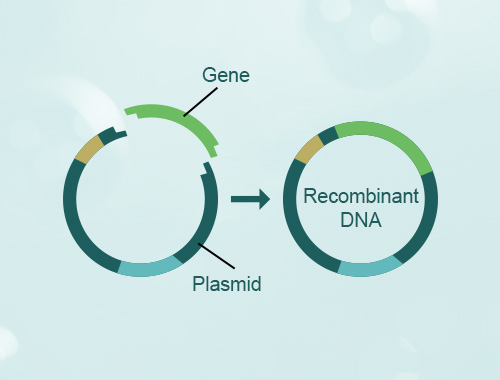
载体选择:选择适当的载体作为基础,常见的载体包括质粒、噬菌体、cosmid等。载体应具备所需特性,如适当的起始子、多克隆位点、选择标记等。
外源基因插入:将目标基因通过限制性内切酶切割,与载体进行连接。连接方式可以使用连接酶(如T4 DNA连接酶)、DNA连接酶或重组酶等。
转化:将构建好的载体转化至宿主细胞,通常是大肠杆菌。转化可以通过热激转化、电穿孔法、化学法等方法实现。
诱导表达:在转化后的细菌培养基中添加适当的诱导剂(如IPTG或拉氏感光剂),使得表达载体中的启动子受到诱导,从而促进外源基因的表达。
培养和收获:将转化后的细菌培养在适宜条件下,通常是在含有选择抗生素的培养基上进行。培养时间和温度可以根据实验需要进行调节。随着培养的进行,外源基因将会得到转录和翻译,产生所需的蛋白质。
鉴定和纯化:通过酶切、PCR、Western blot等技术验证表达的外源基因,并采取适当的纯化方法(如亲和层析、凝胶过滤等)纯化所需的蛋白质。
原核载体构建和诱导表达实验需要遵循严格的操作规范和实验安全指导。此外,具体步骤可能会根据实验设计、载体类型和表达系统的要求而有所不同。
上一条:人鼠嵌合型单克隆抗体的制备










