qRT-PCR(实时荧光定量PCR)实验原理与数据分析技术详解
实时荧光定量PCR(quantitative Real-Time PCR,简称qRT-PCR)是一种高灵敏度、高特异性的分子生物学技术,广泛应用于基因表达分析、病原体检测、转基因鉴定及microRNA研究等领域。其核心在于在PCR扩增过程中实时监测荧光信号的累积,从而实现对起始模板量的精确定量。以下从实验原理、技术类型、操作流程到数据分析方法进行系统详述。
一、实验原理
qRT-PCR的本质是将传统PCR的终点检测转变为扩增过程中的实时动态监测。DNA聚合酶在每一轮循环中合成新链,若反应体系中加入能与双链DNA结合或序列特异性识别的荧光标记物,则随着产物增加,荧光强度同步增强。仪器通过光学系统实时采集每个循环的荧光值,绘制“扩增曲线”。关键概念包括:
Ct值(Cycle threshold):荧光信号超过设定阈值(通常位于指数扩增期)所需的循环数。Ct值与起始模板量呈负相关——模板越多,Ct值越小。
指数扩增期:理想情况下,前15–30个循环中产物以2倍速率增长(效率≈100%),此阶段的数据用于定量最为可靠。
需注意,“qRT-PCR”常被误用为泛指所有实时定量PCR,严格而言:
若检测对象是mRNA,需先通过逆转录(Reverse Transcription, RT) 将RNA转为cDNA,再进行qPCR,此时应称 RT-qPCR;
若直接检测DNA模板(如拷贝数变异),则为 qPCR。

二、荧光检测技术类型
目前主流有两类荧光化学体系:
非特异性染料法(如SYBR Green I)
SYBR Green I可嵌入任何双链DNA的小沟中,发出强荧光。优点是成本低、操作简便;缺点是无法区分特异性产物与引物二聚体或非特异扩增,需通过熔解曲线(Melting Curve)验证产物单一性——单一峰表明扩增特异。
序列特异性探针法(如TaqMan探针)
探针是一段与目标序列内部区域互补的寡核苷酸,5'端标记报告荧光基团(如FAM),3'端标记淬灭基团(如TAMRA)。完整时荧光被淬灭;当Taq酶在延伸过程中发挥5'→3'外切酶活性,水解探针,使报告基团释放,产生荧光。该方法特异性高,适用于多重检测(不同探针用不同荧光染料),但成本较高、设计复杂。
三、实验操作关键步骤
样本准备:提取高质量RNA(若做RT-qPCR),避免降解;用DNase处理去除基因组DNA污染。
逆转录(仅RT-qPCR需要):使用Oligo(dT)、随机引物或基因特异性引物将RNA反转录为cDNA。
引物/探针设计:跨内含子设计以避免gDNA扩增;产物长度80–200 bp为宜;Tm值58–62°C;避免二聚体和发夹结构。
反应体系配置:包含模板cDNA/DNA、引物(或引物+探针)、dNTPs、热稳定DNA聚合酶、缓冲液及荧光染料。
运行程序:通常包括预变性(95°C, 2–10 min),随后40–45个循环的变性(95°C, 10–15 s)—退火/延伸(60°C, 30–60 s),部分仪器合并后两步。
熔解曲线分析(SYBR Green法必需):从60°C缓慢升温至95°C,监测荧光下降,确认单一产物。
四、数据分析技术
定量分析的核心是相对定量或绝对定量。
(1)绝对定量
需构建标准曲线:用已知浓度的模板(如质粒、体外转录RNA)进行系列稀释(如10⁷–10¹ copies),测定各稀释点的Ct值,绘制“log(起始量) vs Ct”标准曲线。待测样本的Ct值代入方程即可计算其绝对拷贝数。适用于病毒载量、转基因拷贝数等场景。
(2)相对定量(更常用)
用于比较不同样本间某基因的表达差异,无需标准品,常用ΔΔCt法:
首先,用内参基因(如GAPDH、β-actin、18S rRNA)校正样本间加样误差:ΔCt = Ct目标基因 – Ct内参基因

然后,选择一个对照组(如未处理组)作为基准,计算ΔΔCt = ΔCt实验组 – ΔCt对照组

最终相对表达量 = 2–ΔΔCt(假设扩增效率为100%)
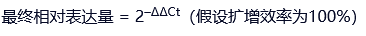
若扩增效率(E)偏离100%(如90%–110%),需用修正公式:相对表达量 = (1 + E)目标–ΔCt目标 / (1 + E)内参–ΔCt内参
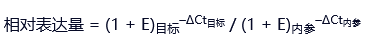
(3)扩增效率验证
通过梯度稀释模板,计算斜率(Slope):E = 10(–1/Slope) – 1。理想斜率为–3.32,对应E=100%。效率应在90%–110%之间,R² > 0.99。
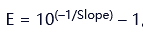
(4)数据可视化与统计
结果通常以柱状图展示相对表达倍数,并辅以误差线(SD或SEM);组间比较采用t检验或ANOVA,p < 0.05视为显著差异。
五、注意事项与常见问题
内参基因稳定性:必须在实验条件下表达恒定,建议用GeNorm或NormFinder软件筛选最佳内参。
无模板对照(NTC):监控污染;无逆转录对照(–RT):排除gDNA干扰。
技术重复:每个样本至少3次重复,减少操作误差。
引物特异性:电泳或测序验证PCR产物。
qRT-PCR凭借其高灵敏度、宽动态范围和良好重复性,仍是基因表达分析的“金标准”。然而,其准确性高度依赖于严谨的实验设计、规范的操作流程和科学的数据处理。只有在充分理解原理并严格控制变量的前提下,才能获得可靠、可重复的定量结果,为后续生物学解释提供坚实依据。










