Cell重磅,Hi-C测序揭示中介体的结构和功能
信息来源:金开瑞 作者:genecreate 发布时间:2019-09-23 11:34:22
题目:A Pliable Mediator Acts as a Functional Rather Than an Architectural Bridge between Promoters and Enhancers
期刊:Cell
影响因子:36.2
主要技术:CRISPR-Cas9,degron,Hi-C,cryo-EM
研究背景
多亚基中介体复合物在真核生物RNA聚合酶II(Pol II)的转录调节中起重要作用。中介体通过未知的机制将功能信息从与增强子结合的TF(Transcription factor)传递到启动子的基础转录机制中。中介体各种亚基的突变导致人类基因表达的显着缺陷和人类疾病。虽然只有一小部分后生动物特异性亚基被报道出对体外转录和胚胎发育至关重要,但是它们的保守性表明它们可能有助于增强高等生物体中转录调控的复杂性。
研究结果
1、mMED的EM分析
为了研究mMED结构和亚基组织,包括后生动物特异性亚基的位置,作者使用cryo-EM获得复合物的亚纳米分辨率图。从CH12小鼠B细胞免疫纯化mMED,其中通过CRISPR-Cas9在MED19的N末端标记FLAG。对163,184个所选图像对准参数的最终改进(来自20个倾斜显微照片的20%),得到总分辨率为5.9A°的mMED低温-EM图(图1A)。作者证实除较大的MED14 C末端外,核心mMED亚基的相对排列与酵母核心中介体有显着的相似性(图 1B)。基于与Sp Mediator的同源性,作者通过确定mMED中的头部,中部和MED14的边界,确定了哺乳动物结构中的所有非核心密度(图1C)。在mMED中,MED14 C末端参与尾部锚定,但核-尾界面相当广泛和复杂,其中包括尾部与头部、中部之间的额外接触(图1C)。
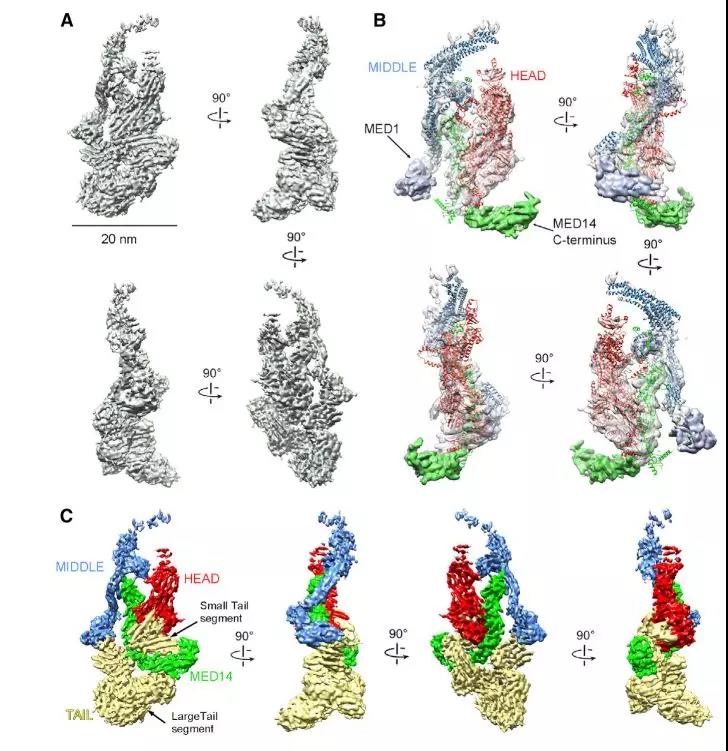
Figure 1. mMED Cryo-EM Map and Module Organization
2、哺乳动物尾部模块的布置和结构
mMED尾部分为两个连接的段。较小的一个(基于其在低温EM图中的体积165 kDa)与头部钳口邻接并且围绕MED14 C末端包裹。第二个较大的尾段(380 kDa)对应于Sc尾模块(图1C)。作者将亚基缺失和标记与EM成像相结合,以揭示特定尾部亚基的位置。观察哺乳动物和酵母尾部之间的结构同源性以及MED23-MED24-MED16尾部子模块表明,较大尾部的中间部分的密度与MED16相对应。3D差异分析显示MED25占据大尾段的中心位置,其楔入MED16,MED23和MED24 N末端的交叉点。这与人类中介体中尾部亚基相互作用的生化分析一致,证实了MED25与MED16,MED23和MED24之间广泛的相互作用。
与yMED相比,后生动物特异性亚基的存在导致尾核界面更加扩展,涉及更多的模块间接触并导致稳定的构象。尾部是TF的主要目标,其增加的复杂性可能为高等真核生物中更复杂的转录调节提供机会(图2)。
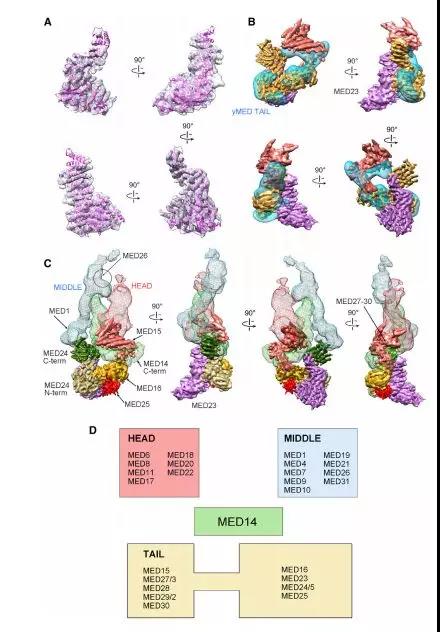
Figure 2. mMED Tail Structure, Subunit Orga nization, and Core Interactions
3、mMED基因分析
为了研究mMED结构的功能意义,作者对小鼠细胞中的中介体进行了全面的遗传分析。作者使用CRISPR-Cas9,以T细胞(原代和EL4),B细胞(CH12)和胚胎干细胞(ESC)中的33个亚基为靶向,分析了总共16,399个靶向克隆。值得注意的是,B,T和ESC之间的遗传筛选率为88%(33个中的29个)(图3A)。总的来说,其中15个亚基对所有细胞类型的生存能力至关重要,而另外14个亚基可以是纯合缺失的(图3A)。
在真核生物中,大多数mMED核心亚基的基本性质是一致的,就是保护核心Mediator和PIC结构。同时,作者的结果暗示哺乳动物细胞的体内转录和整体生存力要求酵母或最小核中无中介体亚基。
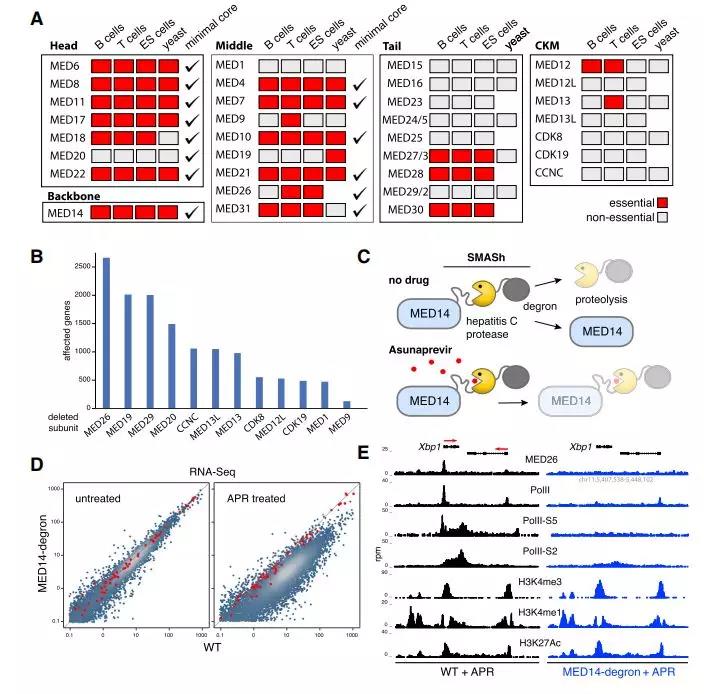
Figure 3. mMED Genetic and Functional Analysis
4、mMED核心亚基的功能分析
作者应用转录组测试不属于尾部的非必需亚基在体内作用,发现每次敲除中仅有相对少量的基因受影响(图3B)。为了确定由mMED调节的全部基因,作者将MED14主链与自我切除的丙型肝炎病毒(HCV)蛋白酶 - degron(SMASh [小分子辅助关闭])融合(图3C)。研究结果支持中介体稳定PIC并促进CTD磷酸化的观点。因此,与调节一部分基因表达的非必需中介体亚基相反,完整复合物是哺乳动物细胞中全局Pol II募集和转录组扩增所必需的。相反,至少在短期内,表观遗传可及性不需要中介体(图3E)。
5、mMED尾部模块的功能分析
mED14-degron的一个限制是它无法区分中介体在启动子激活Pol II的作用与其作为增强子结合TF的停靠位点的作用。当尾部不存在时,Pol II活性在整个基因组中受到轻微影响,单敲除没有显示出这种表型。受影响基因的启动子平均与10个H3K27Ac + H3K4me1 +增强子相关,而未受影响的基因的启动子为6个(p <2.2e16)(图4C)。这支持了mMED尾部在TF和Pol II之间创建功能桥梁的概念。
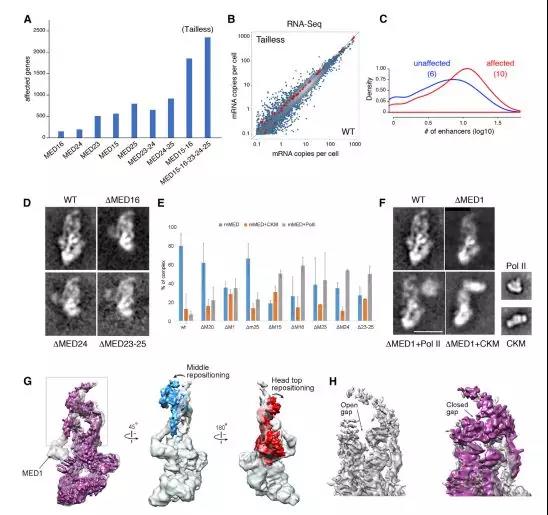
Figure 4. Tailless Mutant and Effect of MED1 and Tail Subunit Deletions on mMED Interaction with Pol II and CKM
6、中介体-POL II和中介体-CKM相互作用的尾部调节
该领域的一个关键问题是中介体如何促进Pol II的TF激活,首先,尾部突变体的Cryo-EM分析发现MED15,MED16,MED24或MED23-MED24-MED25的缺失使尾部模块或其与核心的相互作用不稳定(图4D),这是由于缺乏相应的尾部亚基,而不是由于移动性增加而未能检测到它们的密度。TF和尾部亚基之间的相互作用可能影响尾部结构,因此影响其与核心的相互作用。其次,尾部完整性或与核心相互作用的缺失会对中介体的相互作用产生巨大影响。后生动物特异性亚基可能通过对介体结构和构象的进一步影响而影响介体相互作用。
7、中介体在启动子-增强子相互作用中的作用
在稳定染色质环的情况下TF与中介体的尾部接触,启动子与同源增强子(P-E)相连接。为了直接评估P-E接触是否需要中介体,作者在几乎无mMED的B细胞中原位进行Hi-C。作者认为,P-E的相互作用持续存在于中介体和Pol II急剧耗尽的哺乳动物细胞中。为了评估中介体-Pol II或黏连蛋白对P-E接触的贡献,应用启动子捕获Hi-C(PCHi-C)。研究表明即使没有CTCF环,中介体和Pol II对 PP或PE的相互作用也没有明显的贡献,中介体和Pol II都不需要桥连接来调节DNA(图5和图6)。

Figure 5. P-E Interactions Are Largely Imper[1] vious to Acute Removal of Mediator and Pol II but Dependent on Cohesin

Figure 6. Analysis of Mediator-Pol II Degron
8、MED突变细胞的长期结构变化
作者认为中介体和Pol II可能是通过使环状结构域变得可接近结构蛋白质,间接影响染色质拓扑结构。作者检测无尾部细胞,发现P-E接触在受影响的基因座的转录上升或下降后增加或减少(图7A)。相比之下,当黏连蛋白耗尽时,P-E接触减少50%(图7A)。在少数情况下,整个环结构域丢失或获得(图7B和7C),表明无尾细胞的拓扑表型是间接的。中介体尾部缺失对染色质相互作用的影响可能是由于细胞增殖时结构蛋白募集的下游变化,DNA甲基化和可能的其他表观遗传标记起着可及性作用。因此,虽然中介体和Pol II在启动子和增强子之间建立了一个功能桥梁,但它们在3D中的接近度并不是绝对必需的。
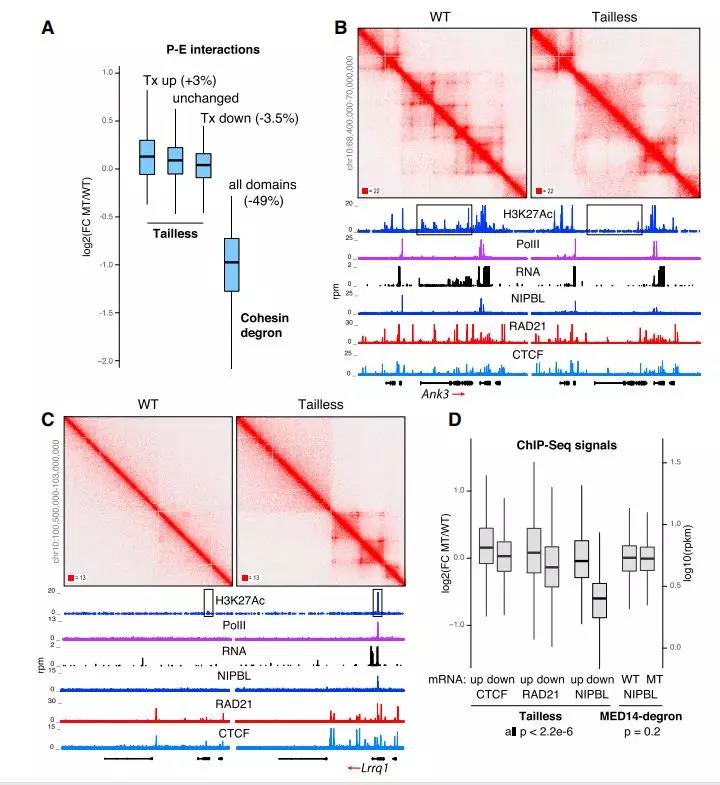
Figure 7. The Impact of Mediator Tail Deletion on Promoter-Enhancer Interactions
总结
虽然中介体在真核转录中起关键作用,但对其作用机制知之甚少。该研究结合了CRISPR-Cas9基因筛选,degron,Hi-C和低温电子显微镜(cryo-EM)来剖析哺乳动物中介体(mMED)的功能和结构。 B细胞、T细胞和胚胎干细胞(ESC)中的缺失分析确定了Pol II募集全基因组所需的核心亚基。相反的,丧失非必需亚基主要影响启动子与多种增强子的连接。与目前的模型相反,束缚调节DNA时mMED和Pol II是不必要的。Cryo-EM分析显示非必需亚基增加了尾部模块的结构复杂性,尾部模块是主要的转录因子靶标。尾部结构的变化显著增加Pol II和激酶模块的相互作用。作者提出中介体的结构柔韧性使其能够整合和传递调控信号,在启动子和增强子之间充当功能者而非桥梁。
最新动态
-
03.19
【客户文献解读,IF>11】食管癌的"隐形推手":MALR-ILF3-HIF1a轴的强大作用
-
03.18
siRNA介绍及药物研发的现状前景
-
03.18
知无不“研”|5篇高分文献带你一览高通量酵母杂交的非凡魅力~
-
02.27
【客户文章分享】SHMT2 通过 5′UTR 依赖性 ADAM10 翻译启动介导小分子诱导的阿尔茨海默病病理学缓解过程
-
01.24
客户文献解读 | 中医为什么能治流感?是玄学还是运气?INT J NANOMED揭示鱼腥草抗病毒机制及范围!
-
01.24
客户文献分享,IF>11|Shank3:脑缺血再灌注损伤的守护者,揭示神经保护的新篇章
-
12.27
文献解读 | 高密度脂蛋白通过miR-181a-5p调控自噬影响血管新生
-
12.27
16分+SCI【客户文章】Nature子刊:鞠怀强/徐瑞华团队揭示FGL1促进转移性结直肠癌免疫逃逸和进展的机制
-
12.13
Science子刊:肠道靶向纳米颗粒可针对产气荚膜梭菌感染提供特异性靶向抗菌肽
-
11.28
医生说:一天一个苹果 ,有没有理论依据?










