客户文献| 基于iTRAQ的定量蛋白质组学分析确定了猪弓形虫感染过程中宿主调控的途径
题目:iTRAQ-based Quantitative Proteomics Analysis Identifies Host Pathways Modulated during Toxoplasma gondii Infection in Swine
期刊:Microorganisms
影响因子:4.152
合作技术:PRM定量蛋白质组学

弓形虫是食源性疾病的主要原因,食用未煮熟的猪肉是感染弓形虫病的主要危险因素,给社会造成沉重负担。
在本研究中,作者使用定量蛋白质组学方法来研究弓形虫感染对猪多种组织蛋白质组的影响。采用串联质谱法,全面了解蛋白质组的功能和调控。进行了生物信息学分析以鉴定差异表达蛋白(DEP),该蛋白可以在弓形虫感染的病理生理学中发挥作用。另外,选择七个DEP用于平行反应监测(PRM)分析,以验证通过质谱分析获得的表达结果。


1. 弓形虫感染的确认
感染组中的所有猪在6 dpi(days post infection [dpi])时都表现出临床体征,例如发烧和食欲不振,而对照组中的猪显然仍然健康。PCR结果显示,感染组的所有收集组织均为弓形虫B1基因阳性。而对照组的组织是B1基因阴性的。
2. 感染组织的蛋白质组学特征
iTRAQ蛋白质组学在猪脑(大脑皮层),肝,肺,肠系膜淋巴结(MLN)和脾脏中分别鉴定了4706、4224、4535、5103和4414个蛋白。在6 dpi时,受感染的脑,肝,肺,MLN和脾脏中的DEPs分别上调了108、125、109、163和140,下调了48、266、61、129和60。在18 dpi时,受感染的脑,肝,肺,MLN和脾脏中的DEPs分别上调了202、171、233、159和141,下调了137、180、250、229和162 (图1A)。在所检查的组织组中未发现常见的DEP。为了验证表达数据,使用PRM进行了靶向质谱分析。脾脏和MLN的七个选定蛋白(HSP90AA1,OXCT1,ARL6IP5,GBP7,GBP1,PDIA3和GVIN2)的PRM表达数据显示与基于iTRAQ的质谱数据相似的表达趋势,从而证明了蛋白表达数据的有效性(图2)。
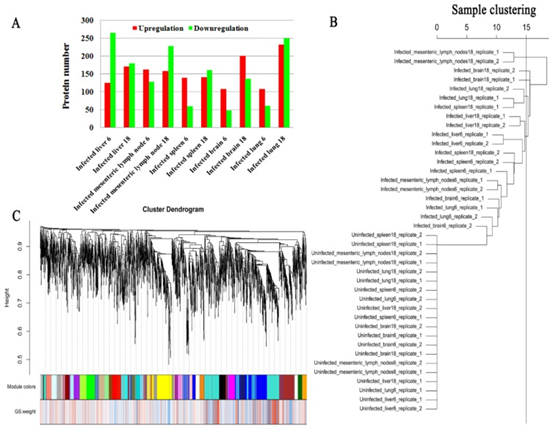
图1 差异表达蛋白质(DEP)以及蛋白质表达谱的共表达分析
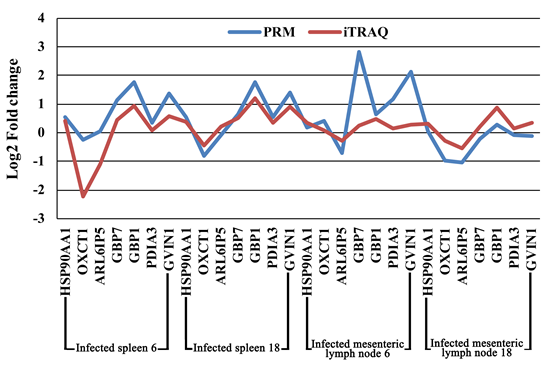
图2 iTRAQ与PRM定量比较
3. 差异表达蛋白质(DEP)的GO和KEGG通路
GO和KEGG对DEP的分析表明,大多数感染组织(包括脑,脾,肺和MLN)的囊泡相关过程均被上调。然而大约190个参与代谢过程的蛋白质在受感染的肝脏中差异表达,其中大多数被下调。这表明弓形虫感染期间肝脏中存在新陈代谢的下调。在所有受感染的组织中,免疫或感染相关途径均被上调。这表明抗弓形虫的机制被激活,其中一些机制在不同组织之间可能很常见,并且对于帮助猪宿主体内抵抗弓形虫很重要。
4. 共表达和性状相关分析
共表达和性状相关分析可以揭示可能有助于抵抗弓形虫感染的常见宿主途径。如图所示图1B,被感染组织的蛋白质谱与未感染组织不同,表明被弓形虫感染已改变了被感染组织的生物学反应。根据蛋白质谱簇树状图,发现了25个蛋白质共表达模块(图1C)。模块,性状和弓形虫基因显著性关系显示在图3A,B,我们发现粉红色模块与弓形虫的感染相关性最高。如图所示3C,对于弓形虫感染,基因模块成员与重要基因之间的全局相关系数为0.6,p值为8.1×10 -31。这些数据表明粉红色模块中的蛋白质与弓形虫感染有关。粉红色模块包含301种蛋白质。表现出对弓形虫感染最重要的最高基因的前30种蛋白质包括:HSP90AA1,PLCH1,SERPINA3-3,HSPA4,GBP1,HSPCB,STIP1,TRIM21,HYOU1,HSPA5,ITGAL,PZP,GVIN1,PDIA3,ERAP1,C3, SLA-DRA,LOC100513619,C4,GP91-PHOX,HSPH1,PLG,GBP7,STAT3,CASP1,HSP90B1,HSPA8,PPIB,TAP1和HSP70.2。前30个基因的相互作用网络显示在图3D,如所有这些基因的AUC所示,所有排名前30位的基因均表现出出色的预测弓形虫感染的能力(图4)。对粉红色模块中基因的KEGG富集分析表明,69条途径显着富集(图5)。
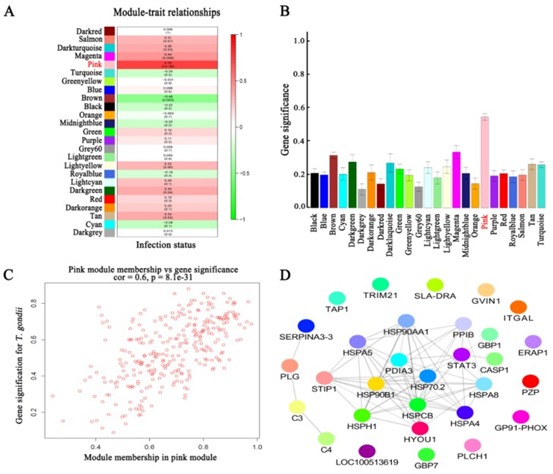
图3 模块和弓形虫感染之间的关系
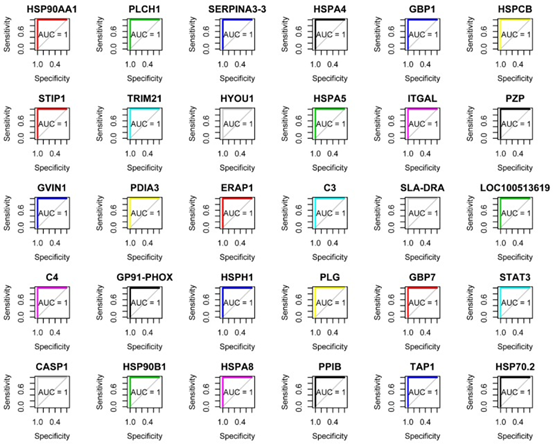
图4 ROC分析和AUC
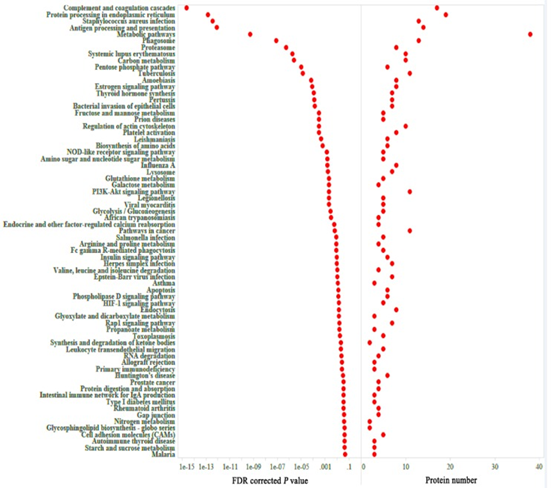
图5粉红色模块中基因KEGG富集分析
5. 潜在抗猪弓形虫蛋白的鉴定和功能分析
粉色模块与弓形虫的感染高度相关。可以预见的是,具有抗弓形虫特性的基因应该与弓形虫的感染高度相关,并在受感染的组织中上调。如图6A所示,粉红色模块中的蛋白质分为上调和下调。我们进一步分析了基因在上调和下调分支中的功能。如图7所示,下调分支的基因在代谢,细胞迁移或相互作用中显着丰富。但是,上调分支的基因在免疫或感染相关途径中显着富集。因此,上调的分支中的基因被认为是PATP。通过分析猪基因组上的基因分布,我们确定了猪染色体7中的两个PATP热点。分布在这两个热点中的大多数基因都参与了抗原呈递或其他与免疫反应相关的途径。
为了确定已鉴定的PATP的功能,使用CRISPR-Cas9方法构建过表达PDIA3-和HSP70.2的细胞系。我们选择了两个高表达的PATP(PDIA3和HSP70.2),它们是前30种蛋白质的中枢蛋白质,用于构建过表达的细胞系。我们的PCR和DNA测序结果表明,PDIA3和HSP70.2过表达已正确插入H11位点(图6C),尽管仅将HSP70.2插入一个H11等位基因。Western印迹分析表明,HA标记的PDIA3和HSP70.2在两种过表达的细胞系中正确表达(图6D)。HSP70.2和PDIA3是抗原呈递途径中的两个关键蛋白,并促进由MHC-1复合物呈递的抗原。如所预期的,与野生型3D4 / 2巨噬细胞相比,HSP70.2和PDIA3过表达的细胞系显示较低的弓形虫载量,尤其是PDIA3过表达的细胞。我们的研究还表明,HSP70.2和PDIA3可以达到弓形虫(图8),表明HSP70.2和PDIA3可能促进弓形虫的抗原呈递,从而有助于限制弓形虫在宿主细胞内的复制。除了HSP70.2和PDIA3,我们还鉴定了许多其他蛋白,这些蛋白可能具有抗弓形虫的特性,并且可以揭示体内针对弓形虫感染的宿主应答新机制。
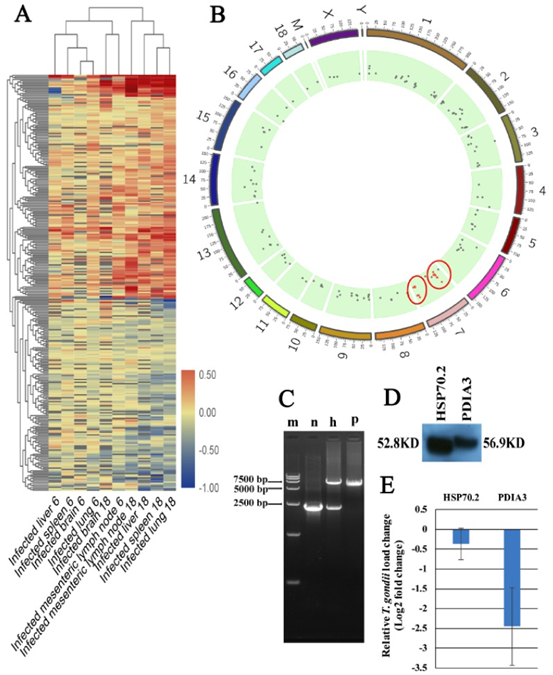
图6 粉红色模块中的基因和潜在的抗弓形虫蛋白(PATP)聚集
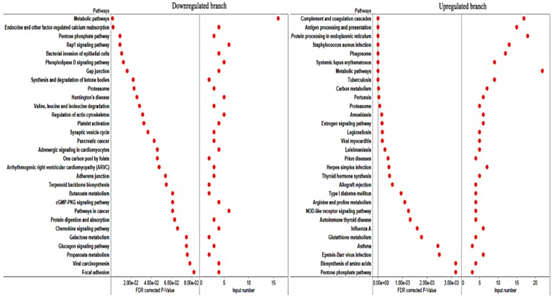
图7 对粉红色模块两个分支中的基因进行KEGG富集分析
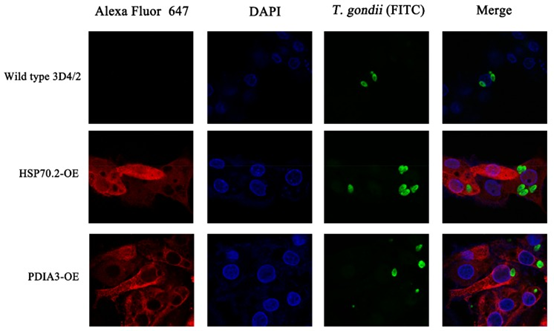
图8 与对照(野生型)细胞相比,稳定过表达(OE)HSP70.2和PDIA3基因的转基因3D4 / 2细胞的免疫荧光分析

用iTRAQ技术研究了弓形虫感染过程中猪脑,肝,肺,脾和MLNs的蛋白表达谱。蛋白质组学分析显示每个受感染组织中的DEP均大于100。免疫反应在所有受感染的组织中均活跃,而在受感染的肝脏中检测到新陈代谢过程下调,而在受感染的大脑中囊泡介导的转运上调。使用性状相关分析,我们确定了25个共表达模块和许多PATP。我们还证明了过表达两个PATP(HSP70.2和PDIA3)的猪巨噬细胞显示出对弓形虫感染的抵抗力增强。进一步阐明本研究中确定的其他PATP的功能将增进我们对猪抵抗弓形虫感染的了解。最终,这项工作可以为抗病猪的发展提供坚实的基础,从而可以减少养猪场中抗寄生虫药物的使用。
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










