16分+SCI【客户文章】Nature子刊:鞠怀强/徐瑞华团队揭示FGL1促进转移性结直肠癌免疫逃逸和进展的机制

摘要
结直肠癌(CRC)是全球范围内第三大常见的癌症,以及第二大癌症死亡原因。在结直肠癌患者的病程中,约50%患者发生肝转移,且预后不良,5年生存率低于20%。结直肠癌肝转移(CRLM)患者通常无法从免疫疗法中获得足够的益处,其潜在机制仍未被充分研究。在这里,我们发现纤维蛋白原样蛋白1(FGL1)降低肝脏微环境中的抗癌免疫来促进CRC的进展。从机制上讲,肿瘤相关巨噬细胞(TAM)通过在肝脏微环境中分泌TNFα/IL-1β激活NF-κB,并在转录水平上调OTUD1的表达,通过去泛素化增强FGL1的稳定性。破坏TAM-OTUD1-FGL1轴抑制了转移性肿瘤的进展,并与免疫检查点阻断(ICB)疗法协同作用。在临床上,癌症患者的高血浆FGL1水平能够预测其预后不良,以及对免疫检查点阻断(ICB)疗法的益处降低。苄索氯铵(Benzethonium chloride)是一种经FDA批准的防腐剂,能够抑制FGL1的分泌,从而抑制了肝转移性肿瘤的生长。总的来说,本研究揭示了FGL1在促进转移性肿瘤进展中的关键作用和翻译后的调节机制,突显了TAM-OTUD1-FGL1轴作为癌症免疫疗法的潜在靶点。
研究思路

结果
FGL1通过肝脏微环境中的免疫抑制促进结直肠癌的进展
该研究首先通过构建小鼠结肠直肠癌(CRC)的肝转移模型,发现在肝脏微环境中FGL1蛋白显著上调。进一步的实验证明,在CRC的肝转移过程中,FGL1通过降低肿瘤浸润T细胞,促进了肿瘤的生长。研究还揭示了FGL1通过与LAG-3结合,抑制抗肿瘤T细胞反应,从而在肝脏微环境中发挥免疫抑制的作用。此外,对FGL1的敲除显著抑制了肝脏微环境中的肿瘤生长,提高了小鼠的整体生存率。综合而言,这些发现揭示了FGL1通过在肝脏微环境中降低肿瘤浸润的T细胞水平来促进转移性肿瘤生长,为开发相关免疫治疗策略提供了理论基础。
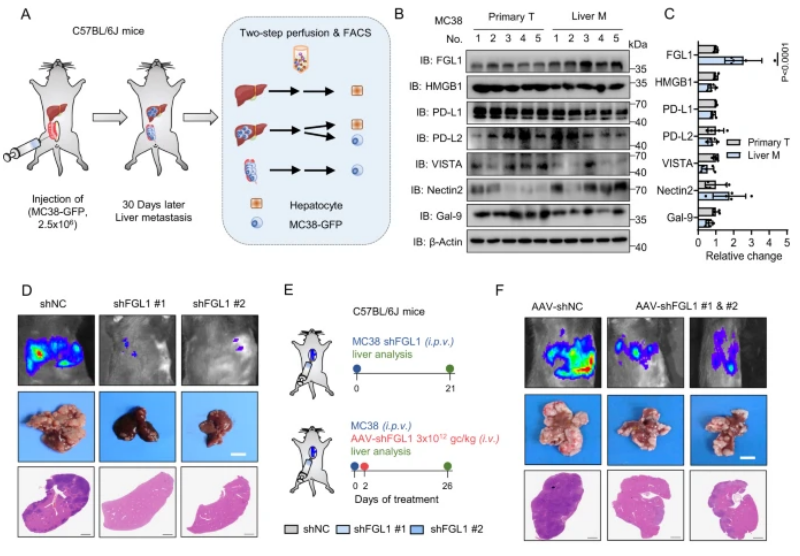
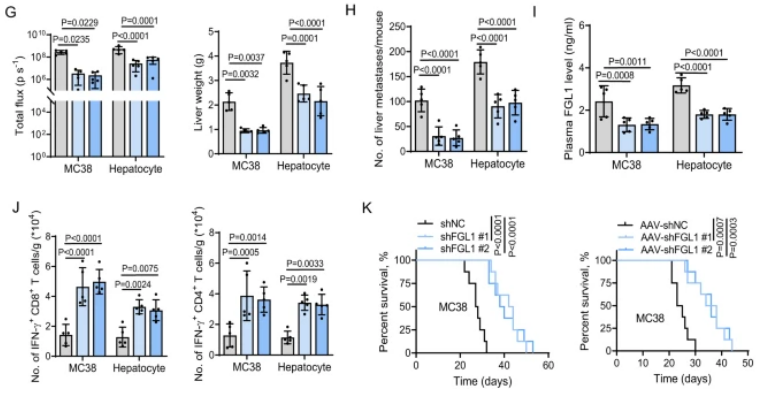
图1:FGL1通过肝脏微环境中的免疫抑制促进结直肠癌的进展
A.构建小鼠CRC肝转移模型,并使用FACS分选细胞。B.在MC38细胞中检测了肝转移肿瘤组织和原发性肿瘤组织中多种免疫抑制分子的表达,包括FGL1。C.使用ImageJ对免疫抑制分子的表达进行了定量估计。D.在C57BL/6 J小鼠中通过门静脉注射对照组(shNC)和FGL1敲除MC38细胞,观察了荧光图像和H&E染色。E.展示了实验策略,包括门静脉注射和静脉注射。F.通过对C57BL/6 J小鼠进行门静脉注射MC38细胞并进行AAV-shNC或AAV-shFGL1(#1,#2)处理,观察了荧光图像和H&E染色。G.MC38细胞或肝细胞中FGL1敲除小鼠的荧光定量和肝重。H、I.MC38细胞和肝细胞中FGL1敲除小鼠的肝转移灶数量和血浆FGL1水平的ELISA检测。J.MC38细胞或肝细胞中FGL1敲除小鼠的肝转移灶中T细胞数量的流式细胞术分析。K.各组小鼠的生存曲线分析。
高FGL1水平预示着不良预后,且从PD-1/PD-L1阻断治疗中获益较少
高FGL1水平与结直肠癌、胃癌和食管鳞状细胞癌患者的不良预后以及在PD-1/PD-L1阻断治疗中的较少临床益处相关。通过分析组织微阵列(SYSUCC),我们发现FGL1在肿瘤组织中表达上调,并在肝转移组织中显著增加。与健康人相比,患者的血浆FGL1水平升高,而有肝转移的患者水平更高。Kaplan–Meier生存分析显示,较高的血浆FGL1水平与不良预后相关。此外,高血浆FGL1水平与结直肠癌或胃癌患者在PD-1/PD-L1治疗中的较差反应有关。在不同治疗队列中,血浆FGL1水平的升高与免疫治疗的不利效果呈负相关。综上所述,高血浆FGL1水平可能是肝转移患者PD-1/PD-L1阻断治疗中临床效果不佳的预测指标。
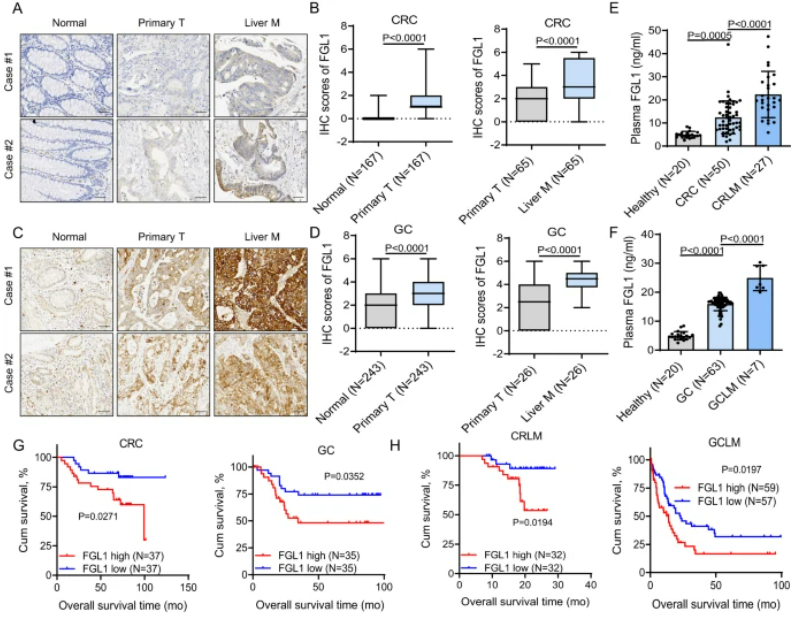
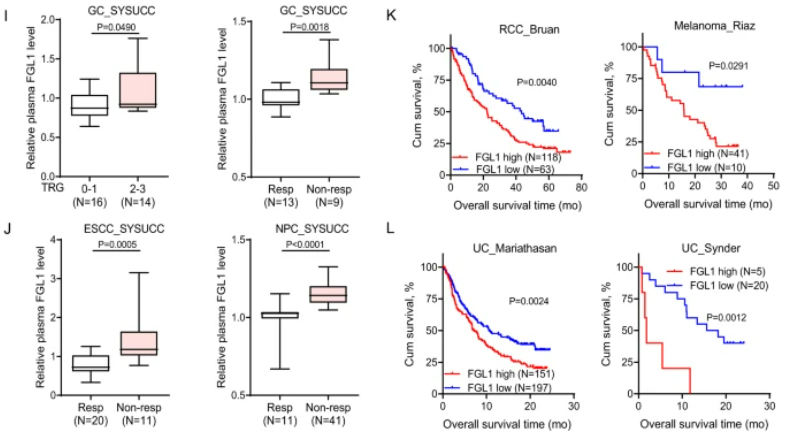
图2:高FGL1水平预示着不良预后,且从PD-1/PD-L1阻断治疗中获益较少
A . 在正常组织、原发性CRC肿瘤和相配对的肝转移组织中的FGL1免疫组织化学染色。B. FGL1的IHC染色评分。C. 在正常组织、原发性GC肿瘤和相配对的肝转移组织中的FGL1 IHC染色。D. FGL1的IHC染色评分。E、F. 通过ELISA检测了健康供体、CRC、CRLM、GC和GCLM患者的血浆FGL1水平。G. Kaplan-Meier分析了CRC和GC患者的血浆FGL1水平与总生存期的关系。H. Kaplan-Meier分析了CRLM和GCLM患者的血浆FGL1水平与总生存期的关系。I、J. 在多个癌症队列中,血浆FGL1水平与抗PD-1治疗的效果呈负相关。L. FGL1表达与接受抗PD-L1治疗的患者总生存期呈负相关。
TAMs通过激活肝脏微环境中的NF-κB促进FGL1的稳定
在CRC肝转移肿瘤中,我们观察到明显改变的肿瘤免疫微环境,尤其是巨噬细胞的显著富集。为了确定TAMs是否参与了肝转移肿瘤中FGL1的过表达,我们分离了来自小鼠及患者LM组织的TAMs,并将其与癌细胞间接共培养。实验证实,TAMs显著增加了CRC细胞中FGL1蛋白的表达,而FGL1的mRNA表达水平未受影响。进一步研究发现,TAMs分泌的TNFα和IL-1β通过转录后调控途径上调了FGL1蛋白表达,该效应可以通过向与TAMs产生的条件培养基(TAM-CM)孵育的MC38细胞中添加中和抗体来挽救。我们进一步揭示了TAMs通过激活NF-κB/p65信号通路来降低FGL1的泛素化,从而增强其稳定性。最后,我们发现敲除p65减弱了TAM介导的FGL1稳定性,与NF-κB活性降低相一致。这些发现揭示了TAMs在肝脏微环境中通过调控FGL1的稳定性,促进CRC肝转移的机制,为肝转移癌的免疫治疗提供了新的见解。
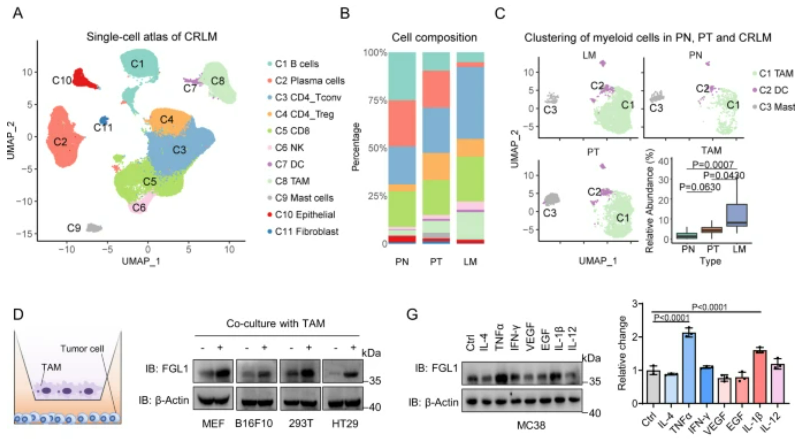
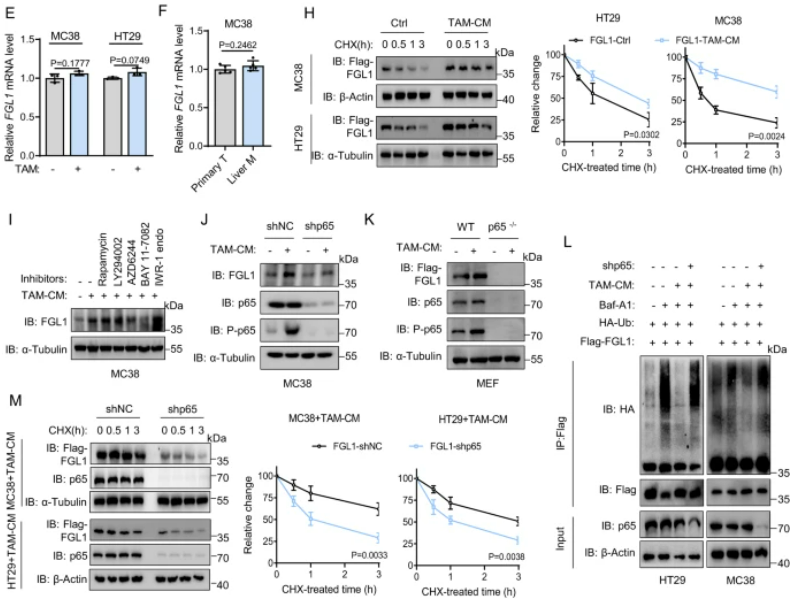
图3:TAMs通过激活肝脏微环境中的NF-κB来促进FGL1的稳定
A.以前发表的CRLM单细胞图谱的UMAP嵌入。B. 堆叠条形图显示在原发正常组织(PN)、原发肿瘤组织(PT)和肝转移组织(LM)中每个簇的细胞比例。C. UMAP嵌入图展示了在PN(n=10)、PT(n=10)和LM(n=10)中的髓细胞相对丰度。D. 与TAMs共培养16小时后,指定细胞中FGL1表达的IB检测。E. 在与TAM共孵育的指定细胞中进行的FGL1 mRNA水平的qRT-PCR分析。F. qRT-PCR分析从原发和肝转移肿瘤组织中分选的MC38细胞的FGL1 mRNA水平。G. IB检测和定量,检测了在给予10 ng/mL的指定细胞因子刺激后,MC38细胞中FGL1的表达。H. 对指定细胞进行IB检测和定量,以检测在给予40 μg/mL CHX处理,TAM-CM共培养后FGL1的表达。I. 在使用TAM-CM孵育的MC38细胞中,经过1小时与指定抑制剂处理的FGL1表达的IB检测。J. 在与TAM-CM孵育的指定细胞中进行的FGL1表达的IB检测。K. 在WT或p65−/− MEFs中过表达Flag-FGL1后,在与TAM-CM孵育后进行的Flag-FGL1表达的IB检测。L. 在使用Baf-A1预处理并经过TAM-CM处理的指定细胞中进行的HA-Ub与Flag-FGL1相互作用的免疫共沉淀分析。M. 在指定细胞中进行的Flag-FGL1表达的IB检测和定量。
去泛素化酶 OTUD1参与TAM介导的FGL1的稳定
通过质谱鉴定,我们发现去泛素化酶OTUD1参与了TAM介导的FGL1蛋白去泛素化和稳定过程。在293T和MEF细胞中,我们通过免疫共沉淀实验证实了OTUD1与FGL1的直接相互作用。通过GST Pull-down实验,我们进一步证实了重组His-OTUD1与GST-FGL1之间的直接相互作用。OTUD1的敲除显著增加了MC38和HT29细胞中FGL1的泛素化和降解,反之亦然。此外,OTUD1的下调取消了TAM介导的FGL1去泛素化并减少了TAM诱导的FGL1稳定。半衰期分析显示,OTUD1的下调减缓了在TAM-CM培养的肿瘤细胞中FGL1的蛋白半衰期。结果表明,OTUD1参与了TAM介导的FGL1稳定和免疫逃逸。
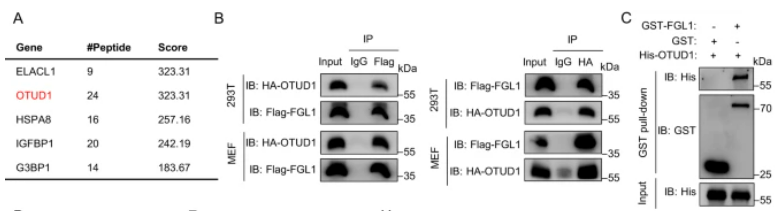
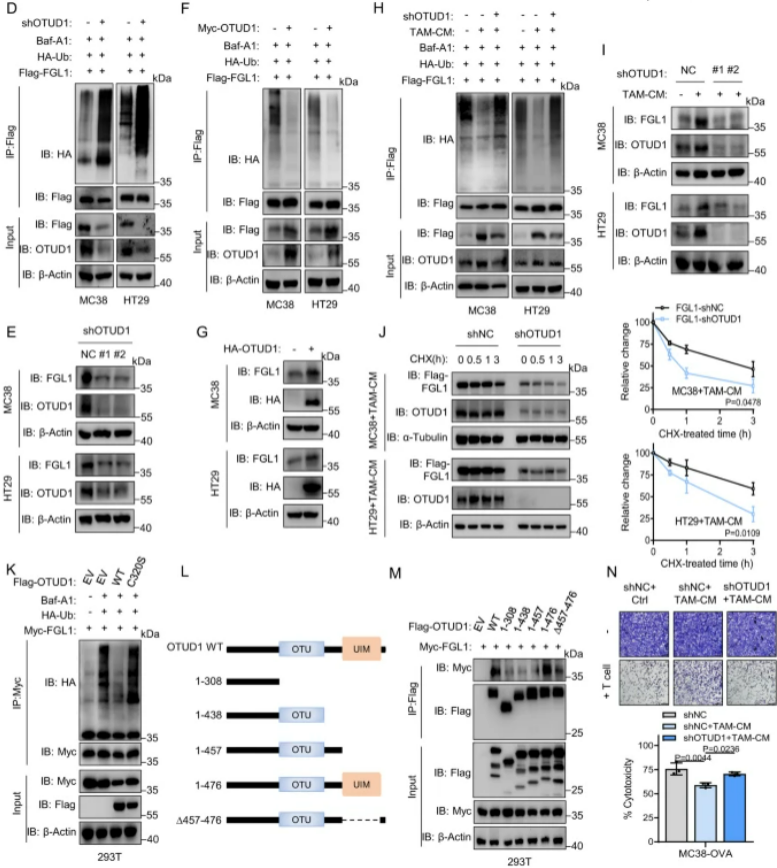
图4:去泛素酶OTUD1参与TAM介导的FGL1的稳定
A. 利用质谱分析揭示了与TAMs共培养的293T细胞中FGL1结合的不同蛋白质,鉴定并验证了去泛素酶OTUD1。B. 在293T和MEF细胞中,通过免疫共沉淀实验验证了HA-OTUD1和Flag-FGL1的直接相互作用。C. GST Pull-down证实了重组His-OTUD1和GST-FGL1蛋白的结合。D. 在OTUD1敲除或对照的MC38和HT29细胞中,预处理Baf-A1后,通过免疫共沉淀分析HA-Ub和Flag-FGL1的相互作用。E. 检测了指示细胞中FGL1和OTUD1的表达。F. 在Myc-OTUD1过表达或对照的MC38和HT29细胞中,预处理Baf-A1后,通过免疫共沉淀分析HA-Ub和Flag-FGL1的相互作用。G. 检测了指示细胞中FGL1和HA-OTUD1的表达。H. 在指示细胞中,预处理Baf-A1后,然后在TAM-CM中培养16小时,通过免疫共沉淀分析HA-Ub和Flag-FGL1的相互作用。I. 检测了指示细胞中FGL1和OTUD1的表达。J. 在指示细胞中,培养在TAM-CM中16小时后,加入CHX不同时间,通过免疫印迹检测和定量FGL1的表达。K. 在过表达Flag-OTUD1、Flag-OTUD1(C320S)或对照的293T细胞中,通过免疫共沉淀分析HA-Ub和Myc-FGL1的相互作用。L. 展示了OTUD1的结构示意图。M. 在293T细胞中,通过免疫共沉淀分析不同Flag-OTUD1截断体与Myc-FGL1的相互作用。N. 经活化的OT-1 T细胞与指示细胞共培养8小时后进行结晶紫染色的图像和定量结果。
文中 Purifed GST FGL1 protein、Purified His-OTUD1 protein由金开瑞提供蛋白表达技术服务
OTUD1通过TAM/NF-κB信号通路转录上调
该研究表明,肿瘤相关巨噬细胞(TAMs)通过激活NF-ĸB/p65信号通路提高FGL1的稳定性,同时去泛素化酶OTUD1参与了TAM介导的FGL1的稳定过程。研究还揭示了NF-ĸB/p65与OTUD1之间存在内在的相互调控关系。NF-ĸB/p65作为转录因子在炎症和免疫等过程中发挥关键作用,通过TCGA和CCLE数据库分析及实验证实,OTUD1的mRNA表达与p65表达呈高度正相关。ChIP-seq数据显示OTUD1启动子区域含有p65结合位点,Luciferase报告基因实验证实了p65对OTUD1启动子的调控作用。通过ChIP-PCR进一步证明了p65在OTUD1启动子区域的结合,而且磷酸化的p65过表达显著增加了OTUD1启动子的活性。总体而言,这些结果表明TAMs通过NF-ĸB/p65激活转录上调OTUD1,揭示了NF-ĸB/p65和OTUD1之间的相互调控关系。
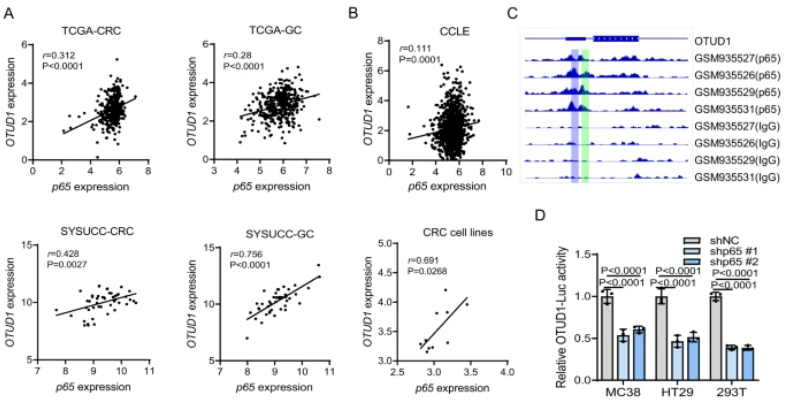
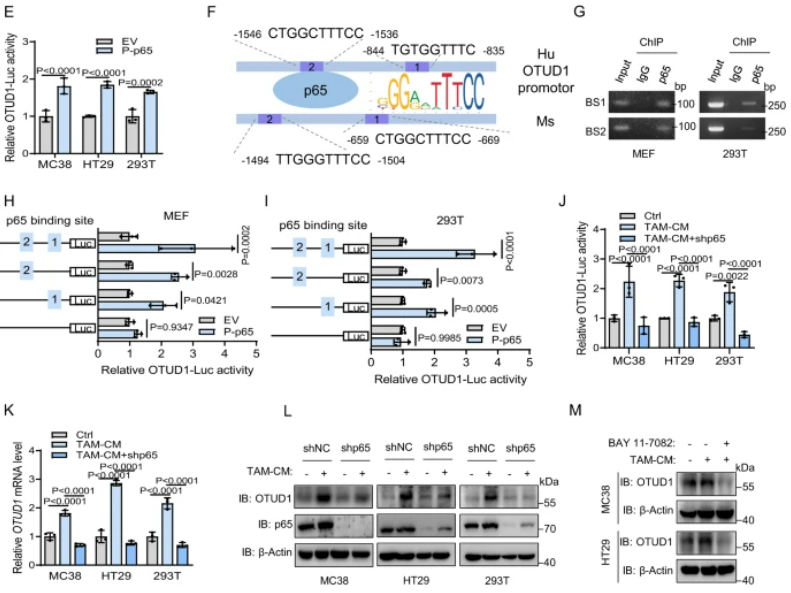
图5:OTUD1通过TAM/NF-κB信号通路转录上调
A. 在TCGA-CRC和TCGA-GC数据集以及SYSUCC数据中,显示了p65和OTUD1在CRC和GC患者中的表达正相关。B. 在CCLE数据集和CRC细胞系中,p65和OTUD1的表达呈正相关。C. 利用ChIP-seq数据显示了OTUD1基因座附近p65的信号。D. 敲除p65降低了MC38、HT29和293T细胞中OTUD1启动子报告基因的活性。E. P-p65过表达增加了MC38、HT29和293T细胞中OTUD1启动子报告基因的活性。F. 人和小鼠OTUD1启动子含有p65结合位点。G. ChIP-PCR分析验证了MEFs和293T细胞中p65与OTUD1启动子的相互作用。H、I. P-p65过表达增加了MEFs(H)和293T细胞(I)中OTUD1启动子报告基因的活性,该效应通过突变p65结合位点得到减弱。J. 敲除p65降低了MC38、HT29和293T细胞中TAM-CM诱导的OTUD1启动子报告基因的活性。K. 敲除p65减少了MC38、HT29和293T细胞中TAM-CM诱导的OTUD1 mRNA水平。L. TAM-CM处理后,MC38、HT29和293T细胞中OTUD1和p65的蛋白水平。M. 使用BAY 11–7082阻断了MC38和HT29细胞中TAM-CM诱导的OTUD1上调。
TAM/TNFα-OTUD1-FGL1轴促进CRLM的免疫逃逸和进展
该研究发现在肝转移的肿瘤微环境中,肿瘤相关巨噬细胞(TAM)通过激活TNFα-OTUD1-FGL1信号轴,增强FGL1的稳定性,从而促进了肝转移的进展。实验结果显示,TNFα诱导的肝转移过程中,FGL1的过度表达与免疫逃逸和肿瘤进展相关,而通过干扰这一信号轴可以抑制转移性肿瘤的发展并激活抗肿瘤免疫应答。在人类结直肠癌肝转移组织中,高FGL1水平与免疫抑制相关,低FGL1水平则与更强的抗肿瘤免疫反应相关。这一研究结果揭示了TAM/TNFα-OTUD1-FGL1轴在肝转移的肿瘤微环境中的关键作用,为未来癌症免疫治疗的发展提供了重要线索。
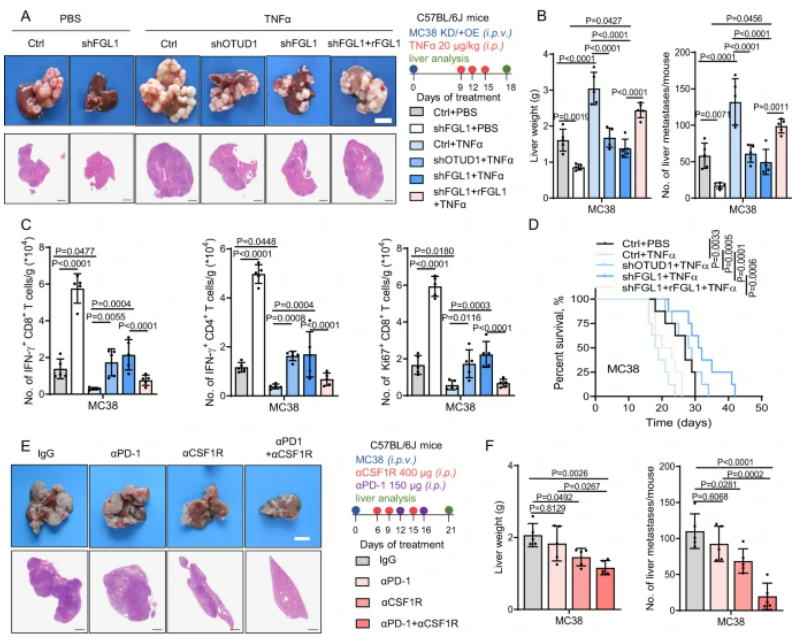
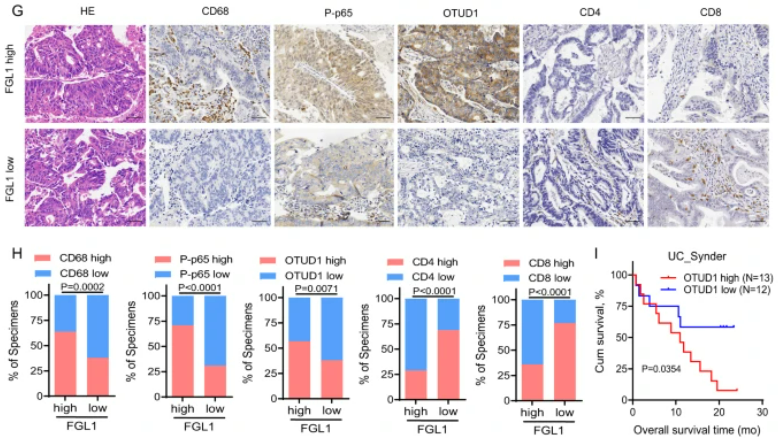
图6:TAM/TNFα-OTUD1-FGL1轴促进结CRLM的免疫逃逸和进展
A. C57BL/6J小鼠接受几种不同处理的MC38细胞门静脉注射,给予TNFα处理后进行肝转移组织的H&E染色。图右显示实验策略。B. 统计每组小鼠的肝重和肝转移灶数量。C. 流式细胞术分析各组小鼠肝转移组织中IFN-γ+ CD8+、IFN-γ+ CD4+和Ki67+ CD8+ T细胞的数量。D. 绘制各组小鼠的生存曲线。E. 图示C57BL/6J小鼠接受MC38细胞门静脉注射后,并接受不同抗体的处理,进行的肝转移组织H&E染色图。图右显示实验策略。F. 统计每组小鼠的肝重和肝转移灶数量。G. 对高或低血浆FGL1水平的结直肠癌(CRC)患者进行肝转移组织H&E和IHC染色。H. 高或低血浆FGL1水平组中,CD68、P-p65、OTUD1、CD4和CD8表达的百分比。I. OTUD1在接受抗PD-L1治疗的患者总生存率中的相关性。
苄索氯铵通过减少FGL1的分泌抑制肝脏微环境中肿瘤细胞的进展
我们筛选了1430种FDA批准的药物,发现苄索氯铵显著抑制了FGL1的分泌,而且对肿瘤细胞的活力几乎没有影响。苄索氯铵治疗通过降低癌细胞中的FGL1蛋白表达,有效减少了小鼠模型中的转移性肿瘤负担,而且与抗PD-1疗法协同作用,显著增强了免疫细胞在肿瘤微环境中的活性,延长了小鼠的生存期。总的来说,这些数据表明苄索氯铵和抗PD-1疗法的联合应用在治疗肝转移性肿瘤中可能具有潜在的临床意义。
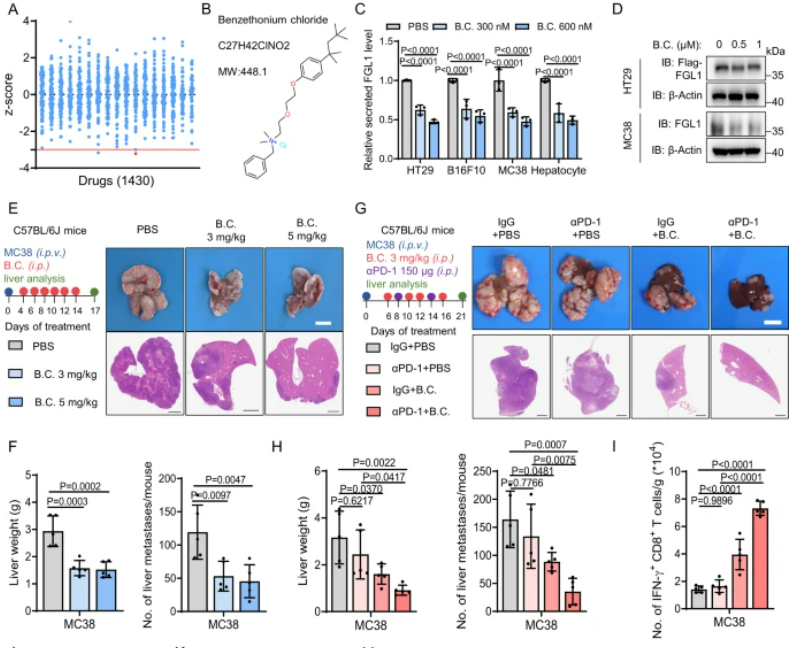
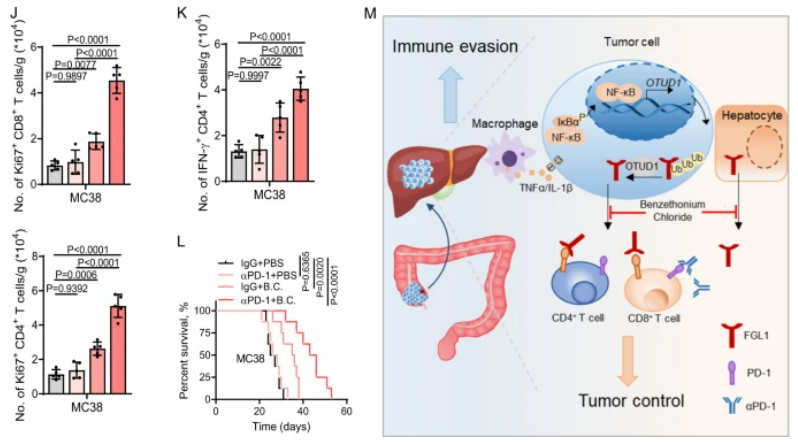
图7:苄索氯铵通过减少FGL1的分泌来抑制肝脏微环境中的肿瘤细胞进展
A.图中的z得分展示了1430种FDA批准药物对HT29细胞中FGL1分泌的影响。B. 苄索氯铵是一种FDA批准药物,其结构如图示。C. 我们筛选了对FGL1水平有抑制作用的候选药物,发现苄索氯铵显著降低了HT29、B16F10和MC38细胞以及小鼠肝细胞中FGL1的分泌。D. 苄索氯铵处理减少了癌细胞中FGL1的蛋白表达。E. 在小鼠模型中,苄索氯铵处理显著降低了肝转移瘤的负担,且不影响宿主体重和肝转移瘤中TAMs的数量。F. 苄索氯铵处理降低了小鼠血浆中的FGL1水平。G. 苄索氯铵处理与抗PD-1疗法协同作用,显著抑制了肝重和减少了肝转移灶的数量。这伴随着肿瘤微环境中IFN-γ+ CD8+/CD4+和Ki67+ CD8+/CD4+ T细胞的增强。I-K. 组合治疗显著延长了小鼠的总体生存。M. 工作模型图展示了肝脏微环境如何通过抑制FGL1分泌来促进抗肿瘤免疫反应。
小结
总的来说,该研究阐明了FGL1在促进转移性癌症进展中的关键作用和调控机制,强调了其预后价值和免疫治疗的临床意义。在小鼠模型中抑制FGL1,能够与PD-1阻断产生协同作用,这提示我们抗FGL1单抗和免疫检查点阻断(ICB)的联合可能是肝转移癌症免疫治疗的新策略。该研究丰富了我们对肝脏微环境中免疫细胞(肿瘤相关巨噬细胞、T细胞)和肿瘤细胞之间的机制联系的理解,这些联系有助于免疫逃逸和癌症进展。
参考文献
https://www.nature.com/articles/s41467-023-42332-0
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










