外泌体—药物靶向治疗利器
信息来源:金开瑞 作者:genecreate 发布时间:2018-05-08 11:55:36
1.外泌体简介
外泌体 (exosomes) 是一种机体内大多数细胞分泌的微小囊泡,直径约为30 ~ 150 nm,具脂质双层膜,其形成机制非常简单,简而言之: “内吞-融合-外排”,如图所示,毫无违和感(图1a)。从1980年首次发现外泌体至今,已有30多年的历史,最初被认为是细胞的“垃圾”,是细胞排泄废物的一种方式;2013年,科学家们发现细胞囊泡运输的调节机制,获得当年诺贝尔生理学或医学奖,开启了外泌体研究的新时代,此外,外泌体和微囊泡(图1b)、凋亡小体(图1c)明显不同,有鲜明的特点和潜在价值,时至今日,已逐步成为科研热点(图2)。
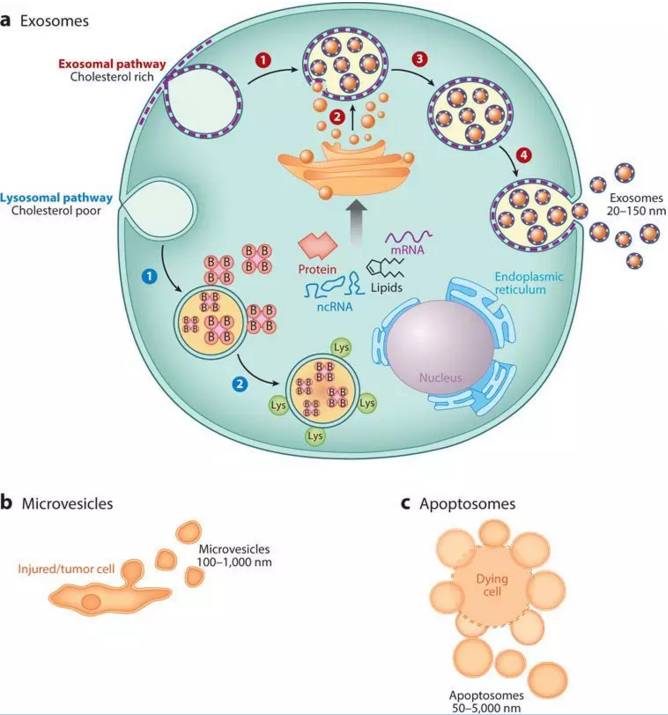
图1
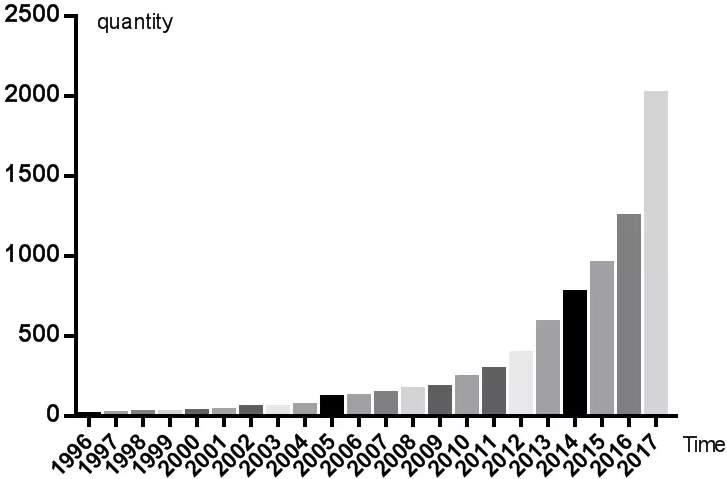
图2
2.外泌体作为药物载体的优势
对于普通药物而言,通常在进入体内后仅有极少一部分才能够真正作用于病变部位。这是制约药物疗效,并导致药物毒副作用的根本原因。获取具有像导弹一样精准靶向能力的药物是人类的一个梦想,也是药物开发的终极目标。随着药物研发进入靶向时代,越来越多的靶向药物成功上市,其中药物载体的设计研发愈发重要。外泌体,作为天然的胞间信息载体,以其相对较小的分子结构,天然分子转运特性及良好的生物相容性,在药物载体领域存在巨大应用潜力。
较之现有的药物载体(如人工制造的脂质体), 外泌体有其显著的优越性:
(1)不同来源外泌体表面分子不一, 对受体细胞有选择性, 治疗上更有利;
(2)相对脂质体对亲水性物质较低的包装效率, 外泌体显著提高包装效率;
(3)特殊细胞[如未成熟的DC细胞或充间质干细胞]中的外泌体, 由于特殊的表 面分子,可避免与抗体、凝血因子等产生作用, 避免体内产生免疫反应。
尽管近年来在siRNA胞内递送方面取得较大进展,但针对特定组织或细胞类型靶向递送,同时避免非特异性递送,特别是对肝脏仍然具有挑战性;其二,siRNA或递送载体的免疫原性也是一个主要障碍。而天然存在的RNA载体,如外泌体,可能会提供一个尚未开发的有效传递策略来源。有研究表明,经过人工设计的外泌体可以通过小鼠的血脑屏障发挥作用(图3)。
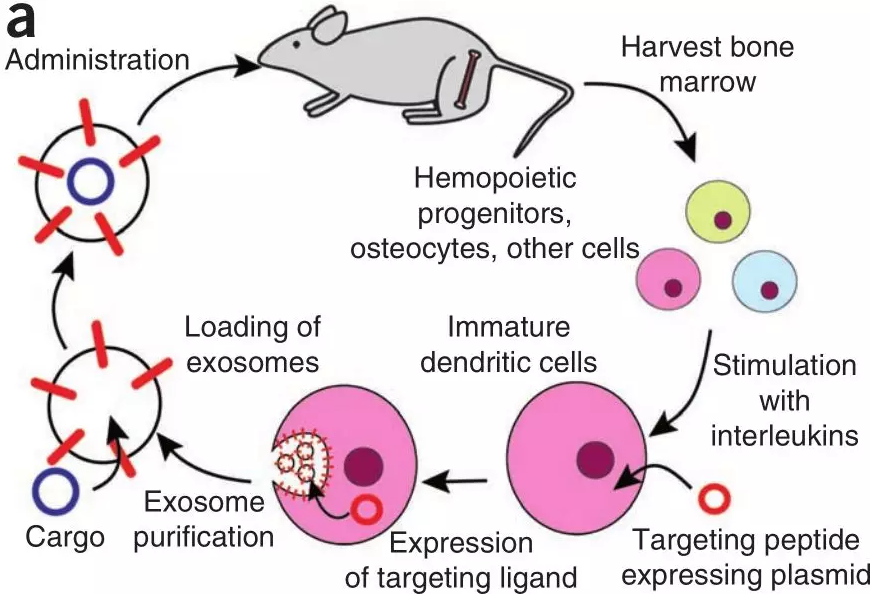
图3
3.外泌体作为药物载体上的应用
外泌体携带和传递重要的信号分子,形成了一种全新的细胞间信息传递系统,影响细胞的生理状态并与多种疾病的发生与进程密切相关,外泌体可装载的药物类型包括小分子化学药物、蛋白质和肽、核酸药物等(图4)。对于外泌体作为药物载体的选择遵循两大基本原则:
1、 保持内含药物在体内环境中的活性;
2、 在不引发机体对药物载体产生免疫反应的情况下释放内含物。
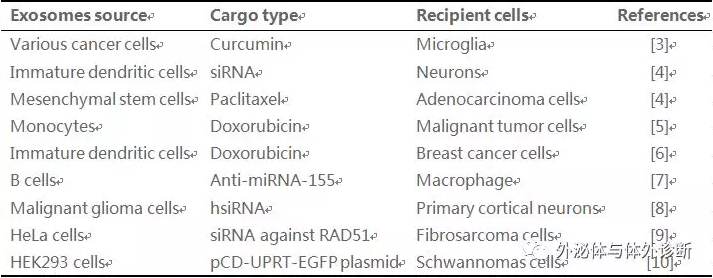
目前已有多篇文献报道外泌体在药物载体上的应用(表1):
Table 1 Exosomes applied as drug carrier
外泌体作为药物载体上的应用方向(图4):
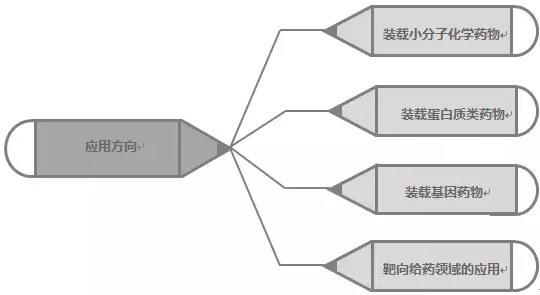
图4
应用案例1:
Extracellular vesicles are the Trojan horses of viral infection. 细胞外囊泡是病毒感染的特洛伊木马。PMID:27232382
Altan-Bonnet [11]发现, 病毒宿主细胞产生的外泌体通过包裹病毒基因组及病毒颗粒运送至新的易染宿主细胞中实现病毒传播, 图4显示了胞外囊泡介导病毒体和病毒核酸种群在两个细胞间非裂解性传输的机制。该过程成为病毒扩散的新途径,进一步阐述了外泌体可应用于药物载体方面的理论 (图5)。
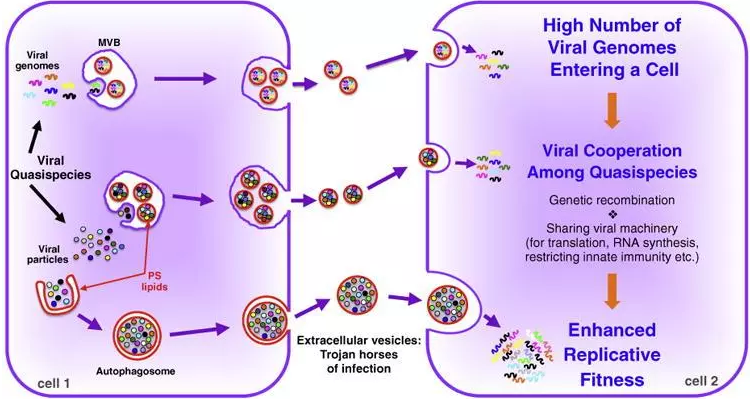
图5
应用案例2:
Exosome-mediated delivery of functionally active miRNA-155 inhibitor to macrophages. 外泌体介导的功能活性miRNA-155抑制剂对巨噬细胞的作用。PMID:24685946
B细胞来源的外泌体可将外源miRNA-155模拟物或抑制剂递送到肝细胞或巨噬细胞中,B细胞的刺激可显著增加外泌体的产生。与亲本细胞不同,经过刺激的B细胞中的miRNA-155含量非常低。而装载miRNA-155模拟物的外泌体可显著敲除小鼠肝脏中miRNA-155水平。此外,与常规转染方法相比,外泌体介导的miRNA-155抑制剂递送可导致更有效的功能抑制和更少的细胞毒性。Momen-Heravi等[12]通过电转使B细胞来源的外泌体装载miRNA-155抑制剂, 作用于RAW(264.7)巨噬细胞, 可以降低脂多糖诱导的TNF-α(tumor necrosis factor-α)产生, 同时减轻体内炎症反应 (图6)。
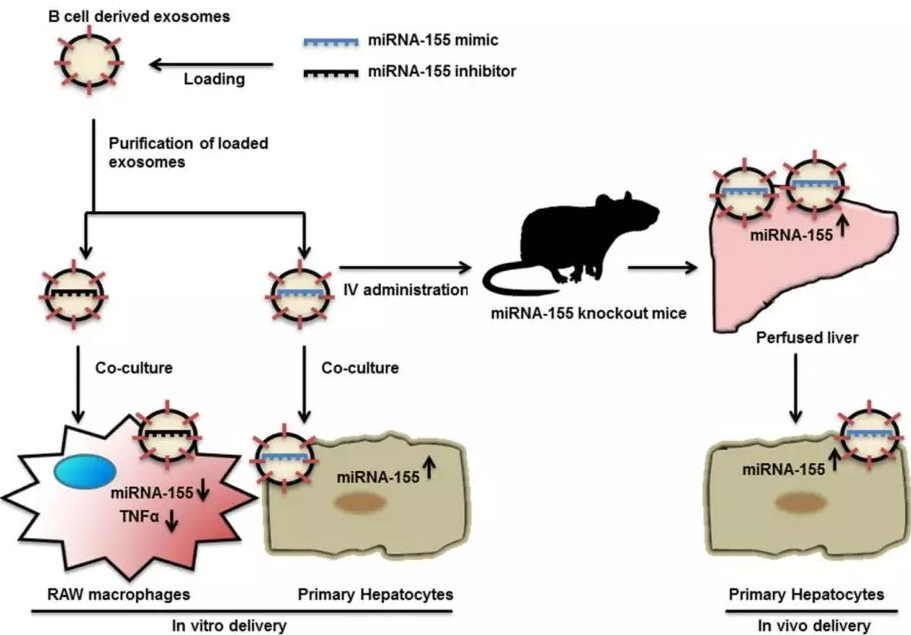
图6
应用案例3:
Exploitation of Exosomes as Nanocarriers for Gene-, Chemo-,and Immune-Therapy of Cancer.利用外泌体作为癌症的基因,化疗和免疫治疗的纳米载体PMID:27319211
目前基于载体的癌症治疗面临的瓶颈,主要是控制治疗剂的靶向和释放。外泌体在尺寸和功能上类似于合成纳米颗粒,优点颇多,使其成为靶向药物或基因递送载体最有希望的候选物。因此,基于外泌体的癌症治疗有可能成为个性化医疗的重要组成部分。目前的大部分综述试图描述外泌体应用于癌症治疗的现状以及与其使用相关的潜在挑战。研究发现,外泌体携带miRNA转染癌细胞可导致基因沉默从而抑制细胞增殖、诱导细胞死亡 [13](图7)。
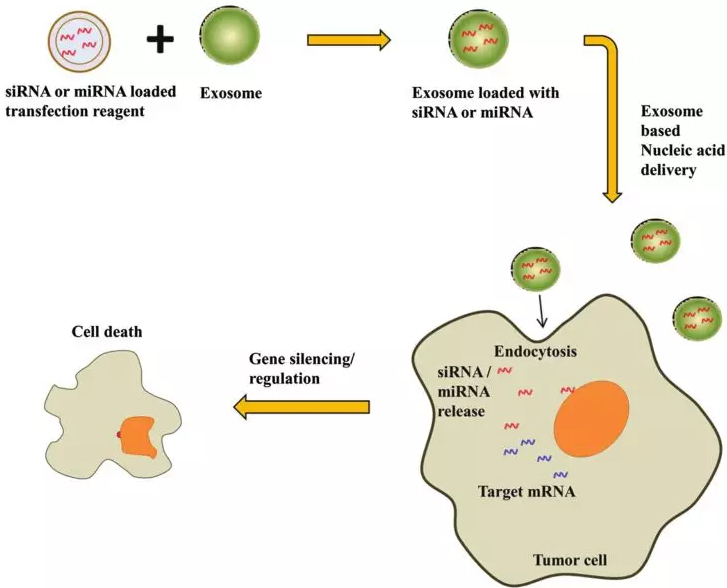
图7
总而言之,外泌体——在药物载体领域存在巨大应用潜力,有望成为药物靶向治疗的利器。
4参考文献
[1]Yeung CLA, Co NN, Tsuruga T, et al. Exosomal transfer of stroma-derived miR21 confers paclitaxel resistancein ovarian canc er cells through targeting APAF1 [J]. Nature communications, 2016, 7: 11150.
[2]Ibrahim A, Marbán E. Exosomes: Fundamental Biology and Roles in Cardiovascular Physiology [J]. Annual Review of Physiology, 2016, 78(1): 67-83.
[3]Srivastava A, Babu A, Filant J, Moxley KM, Ruskin R, Dhanasekaran D, et al . Exploitation of exosomes as nanocarriers for gene-, chemo-, and immunetherapy of cancer. J Biomed Nanotechnol 2016; 12(6): 1159-73.
[4]Pascucci L, Cocce V, Bonomi A, Ami D, Ceccarelli P, Ciusani E, et al. Paclitaxel is incorporated by mesenchymal stromal cells and released in exosomes that inhibit in vitro tumor growth: A new approach for drug delivery. J Control Release 2017; 192: 262-70.
[5]Jang SC, Kim OY, Yoon CM, Choi DS, Roh TY, Park J, et al. Bioinspired exosomemimetic nanovesicles for targeted delivery of chemotherapeutics to malignant tumors. ACS Nano 2016; 7(9): 7698-710.
[6]Tian Y, Li S, Song J, Ji T, Zhu M, Anderson GJ, et al. A doxorubicin delivery platform using engineered natural membrane vesicle exosomes for targeted tumor therapy. Biomaterials 2014; 35(7): 2383-90.
[7]Momen,Heravi F, Bala S, Bukong T, Szabo G. Exosomemediated delivery of functionally active miRNA155 inhibitor to macrophages. Nanomedicine 2014; 10(7): 1517.
[8]Didiot MC, Hall LM, Coles AH, Haraszti RA, Godinho BM, Chase K, et al. Exosome-mediated delivery of hydrophobically modified siRNA for Huntingtin mRNA silencing. Mol Ther 2016; 24(10): 1836-47.
[9]Shtam TA, Kovalev RA, Varfolomeeva EY, Makarov EM, Kil YV, Filatov MV. Exosomes are natural carriers of exogenous siRNA to human cells in vitro. Cell Commun Signal 2013; doi: 10.1186/1478-811X-11-88
[10]Mizrak A, Bolukbasi MF, Ozdener GB, Brenner GJ, Madlener S, Erkan EP, et al. Genetically engineered microvesicles carrying suicide mRNA/protein inhibit schwannoma tumor growth. Mol Ther 2017; 21(1): 101-8.
[11]AltanBonnet N. Extracellular vesicles are the Trojan horses of viral infection. Curr Opin Microbiol. 2016; doi: 10.1016/j.mib.2017.03.005.
[12]Momen,Heravi F, Bala S, Bukong T, Szabo G. Exosomemediated delivery of functionally active miRNA155 inhibitor to macrophages. Nanomedicine 2014; 10(7): 1517.
[13]Srivastava A, Babu A, Filant J, Moxley KM, Ruskin R, Dhanasekaran D, et al . Exploitation of exosomes as nanocarriers for gene-, chemo-, and immunetherapy of cancer. J Biomed Nanotechnol 2016; 12(6): 1159-73.
上一条:酵母双杂交的那些事
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










