Nature子刊!小鼠胃发育过程多组学图谱
信息来源:金开瑞 作者:genecreate 发布时间:2019-02-14 13:18:11
题目:A time-resolved multi-omic atlas of the developing mouse stomach
小鼠胃发育过程多组学图谱
期刊:Nature Communications
影响因子:12.353
主要技术:Label-free
研究背景
哺乳动物的胃结构高度多样化,其器官功能依赖于正常的胚胎发育。尽管已有多项关于胃发育过程中形态学变化的研究,但是大多数胃发育研究都集中在一小组蛋白质或特定途径上,阻碍了对系统生物学中整个过程的理解,缺乏对潜在分子变化的全系统分析。
研究内容及结果
1. 小鼠胃发育的蛋白质组学图谱
为了绘制发育中的小鼠胃的蛋白质组图谱,作者选择了15个时间点收集小鼠胃样品,覆盖胚胎期(E12.5即胚胎第12.5天、E13.5、E14.5、E15.5、E16.5、E17.5和E18.5)、产后天(D1、D3、D5)和产后周(W1、W2、W3、W6、W8),每个时间点3个生物学重复(图1a)。作者使用Label-free定量蛋白质组学共鉴定到12108种蛋白质。一般而言,管家蛋白,例如TUBB4B和HSP90B1,在整个发育阶段表现出稳定的表达,在对数变换后,蛋白质的相对丰度(iFOT)跨越约8个数量级,这反映了胃蛋白质组的高度动态性质(图1e)。作者选取了2890种蛋白质代表胃蛋白质组的核心组分,这些蛋白质的功能在多种途径中显著富集,包括代谢、剪接体、蛋白质加工和其他途径(图2)。
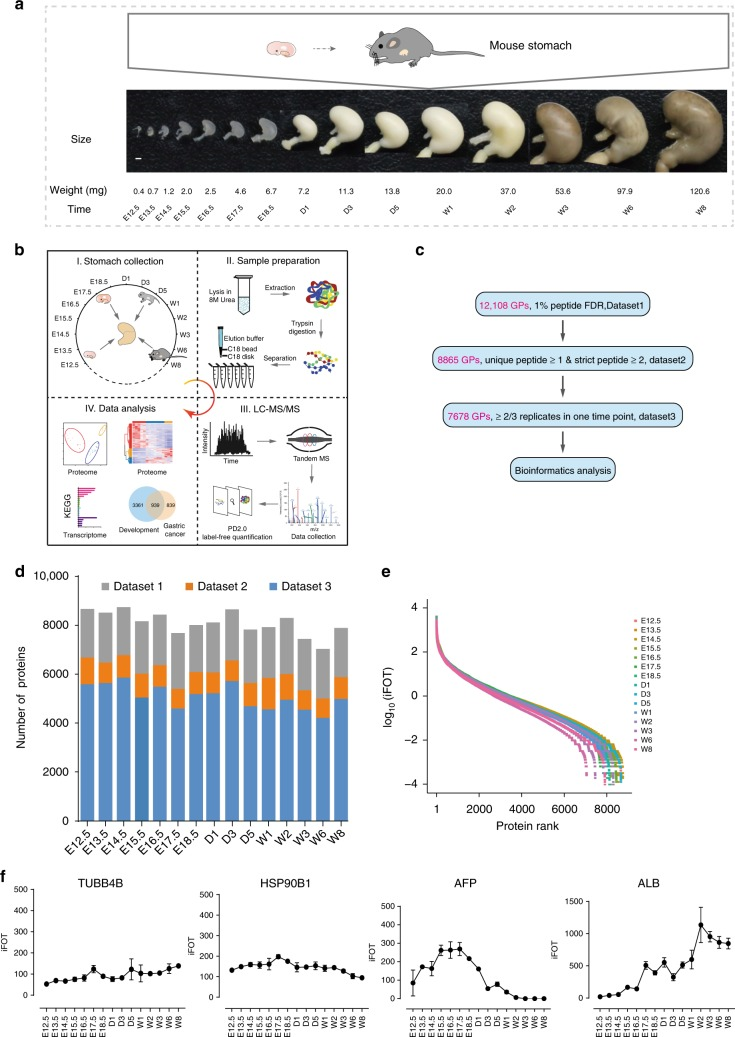
图1 小鼠胃发育蛋白质组学

图2 核心蛋白KEGG分析
2. 小鼠胃发育的三个不同阶段
蛋白质机制的变化决定了器官发生和发育。虽然整个发展过程是逐渐发生变化的,但在某个关键阶段会发生显著变化。为了在蛋白质表达水平上研究这些变化,作者进行了无监督层次聚类分析(HC)和主成分分析(PCA),发现两种分析方法都将实验划分为三个明显不同的阶段:Ph1 (E12.5-E16.5),Ph2 (E17.5-W2)和 Ph3 (W3–W8)(图3a)。为了鉴定每个阶段的代表性蛋白质并了解它们的生物学意义,作者对三个阶段的4300个差异表达蛋白进行了蛋白质共表达分析和KEGG分析(图3b,c)。KEGG分析表明Ph1与细胞分裂有关。Ph1具有最多的差异表达蛋白,主要参与剪接体、RNA转运、DNA复制、细胞周期和嘧啶代谢等通路途经(图2c)。Ph2涵盖围产期和哺乳期,是胃在形状和质量上增长最快的阶段,Ph2具有最少数量的高表达蛋白质,富含ECM-受体相互作用、溶酶体和粘着斑(图2c)。Ph3是成熟期,胃已经获得代谢功能,当婴儿小鼠断奶(出生后20-22天)并开始吃食物36时,Ph2和Ph3之间的边界位于W3。
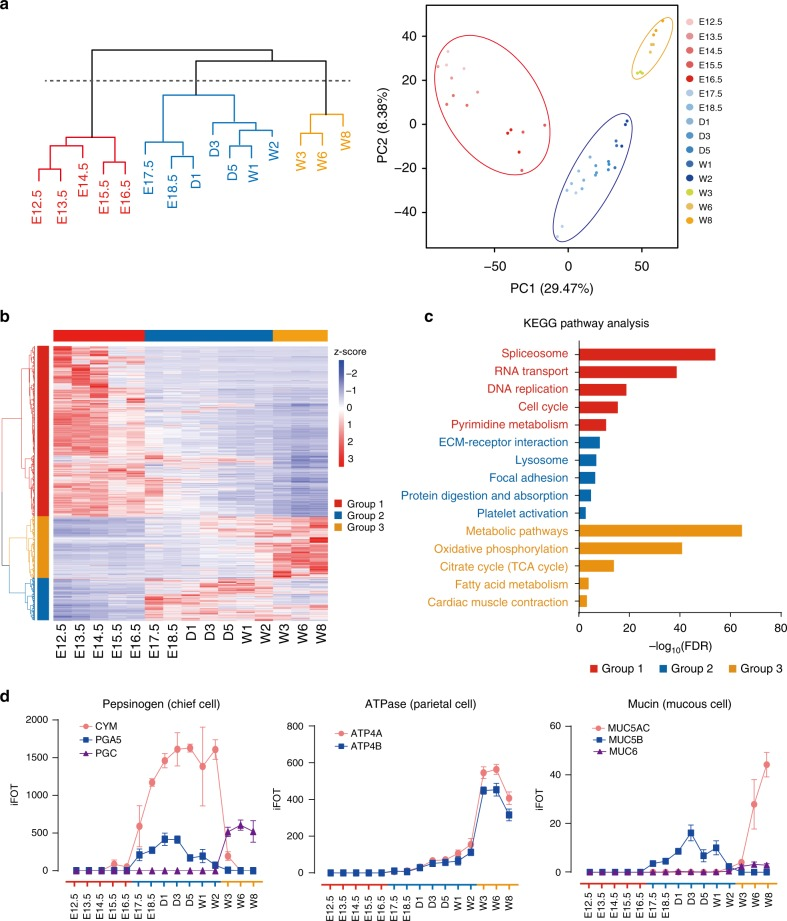
图3 小鼠胃三个发展阶段及其生物功能
3. 胃发育过程中关键胃蛋白的动态变化
作为主要的消化器官,胃产生许多消化酶,因此,作者追踪了胃发育过程中三个重要的胃蛋白酶原(CYM、PGA5和PGC)的表达动态变化(图3d)。CYM和PGA5在Ph2中高度表达,PGC仅在Ph3中检测到。Ph2中的小鼠以牛奶为食,高水平的CYM和PGA5表明它们可能在乳蛋白消化中起重要作用。W3期检测到PGC,并且其在W3后维持在高水平,这一发现与已报道的PGC在成人胃中表达结果一致。胃蛋白酶原在胃质子泵产生的酸性环境中被激活,胃质子泵是存在于胃泌酸粘膜壁细胞中的H+/K+-ATP酶,它有两个亚基(ATP4A和ATP4B),是介导酸分泌的离子传输系统的关键部件之一。ATP4A和ATP4B的表达水平在Ph2中同时增加并在Ph3中达到峰值(图3d),标志着随着小鼠胃成熟,壁细胞在Ph2和Ph3中的形成和成熟。
在胃中高度表达的其他蛋白质(ANXA10、CLDN18、CTSE、GHRL、GIF、TFF1和VSIG1)维持正常的胃功能(图4)。其中,GIF是由胃主细胞产生的糖蛋白;ANXA10是在胃粘膜中表达的钙和磷脂结合蛋白;VSIG1是腺体胃上皮细胞正常分化所需的细胞粘附蛋白;CLDN18是胃上皮相关的密蛋白。在发育的Ph3中这些蛋白质的逐渐增加表明它们可能是成熟胃的标志物。
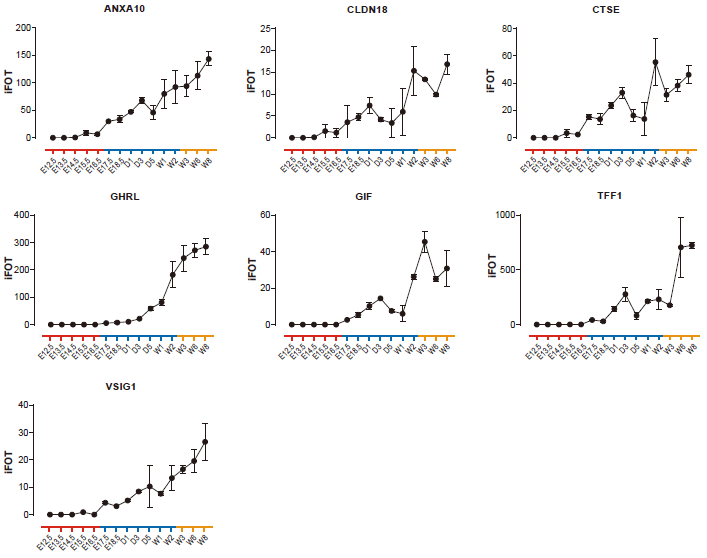
图4 七种胃蛋白在小鼠胃发育中表达变化
4. 差异表达剪接异构体
基于MS的蛋白质组学分析的同时,作者还在相同时间点的小鼠胃组织上进行高通量RNA-Seq分析,两个数据集同时鉴定到10994个基因。转录组数据的无监督层次聚类分析(HC)和主成分分析(PCA)将整个小鼠胃发育过程分成两个阶段(图5a)。该分类几乎完全与从蛋白质组数据获得的3个阶段重叠,仅有与基于转录组的分类的一个时间点(E17.5)差异。这些观察结果表明,基于蛋白质或RNA表达水平,从E12.5到W8的发育过程可大致分为三个阶段。半监督层次聚类分析基于其时间表达模式将基因分为四组(图5b),第一阶段差异表达的大多数基因富含几种途径,例如剪接体、RNA转运和细胞周期(图5c);第二阶段包含两个参与粘着斑、ECM-受体相互作用,几种信号传导途径和脂肪酸或氨基酸降解的基因组;第三阶段主要与氧化磷酸化和代谢活动有关。总体而言,基于RNA-Seq的聚类分析揭示了三个阶段,与蛋白质组数据获得的生物学特征有相似性。
前人研究揭示了剪接异构体在各种生物过程中的作用,如器官发育,当通过FPKM≥1过滤时,作者发现7769个基因的24346种剪接异构体,其中2989种异构体在三个阶段(基于RNA-Seq的聚类)差异表达,在这些通路调节因子或转录因子中,并非所有剪接异构体都发生显著变化,其中一些变异体在mRNA水平上没有或非常低表达(图5d)。这些结果表明,只有一小部分剪接异构体在蛋白质水平上表达,并且在功能上与胃发育有关。
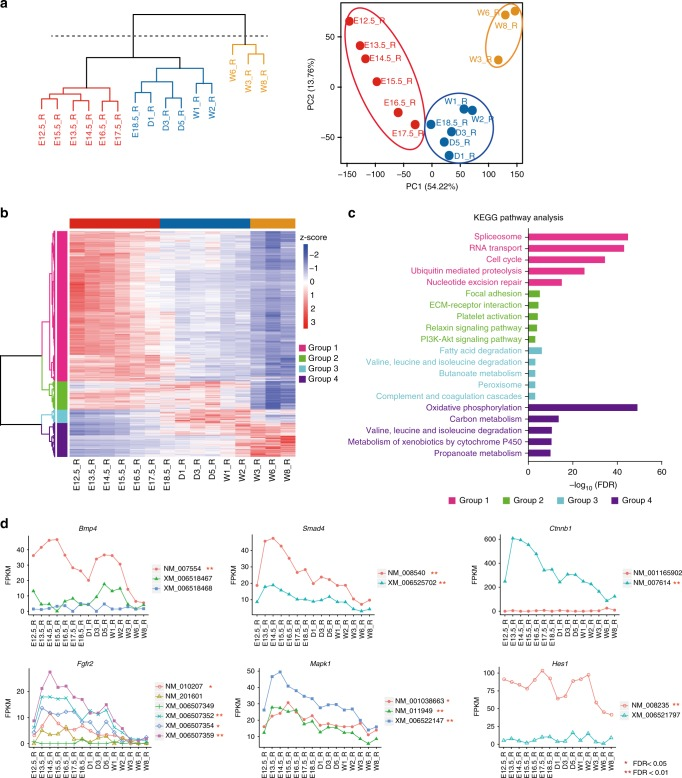
图5 小鼠胃发育转录组学
5. 胃发育与胃癌的相关性
作者收集84名弥漫型胃癌患者白质组数据集,在蛋白质组水平上研究胃发育和胃癌的相关性。作者用蛋白质组学和转录组学方法分别鉴定到241和725个转录调节因子,发现在与器官发育和癌症相关的充分表征的转录调节因子中。当细胞处于快速分裂和增殖时,它们中的大多数在早期胚胎阶段(Ph1)中更高表达,例如CDX2是胃癌的预后标志物,其RNA在胃发育的早期阶段升高。
在胃发育的八个关键信号通路中的蛋白质或基因中,有大量蛋白质或基因在胃发育三个阶段中差异表达(图6)。大部分这些基因在弥漫型胃癌(DGC)也是差异表达或突变基因。如Wnt信号通路中的WNT5A显著上调,而Apc和Ctnnb1在DGC中突变。胃发育和DGC中这些调节因子的改变清楚地表明,转录调节因子和胃癌中的信号传导途径的失调。
为了进一步将胃发育与胃癌的信号通路水平相关联,作者进行双尾超几何统计检验以确定在胃发育和DGC之间的特定途径上是否存在改变的基因产物显著重叠。发现除hedgehog信号通路外的所有途径均表现出高度相关性(-log10P-value >3)(图7a),表明胃发育和胃癌的发生可能是两个相关的过程。为了获得DGC中鉴定的上调蛋白在胃发育中表达的全局视图,作者将939种肿瘤差异表达的蛋白质映射到小鼠胃发育期间的15个时间点中,发现 Ph1 鉴定出蛋白质的百分比明显高于后期时间点(图6b)。这说明胃癌与胚胎胃发育具有许多共同特征,并且该疾病可能由转录因子和细胞信号传导的失调引起。
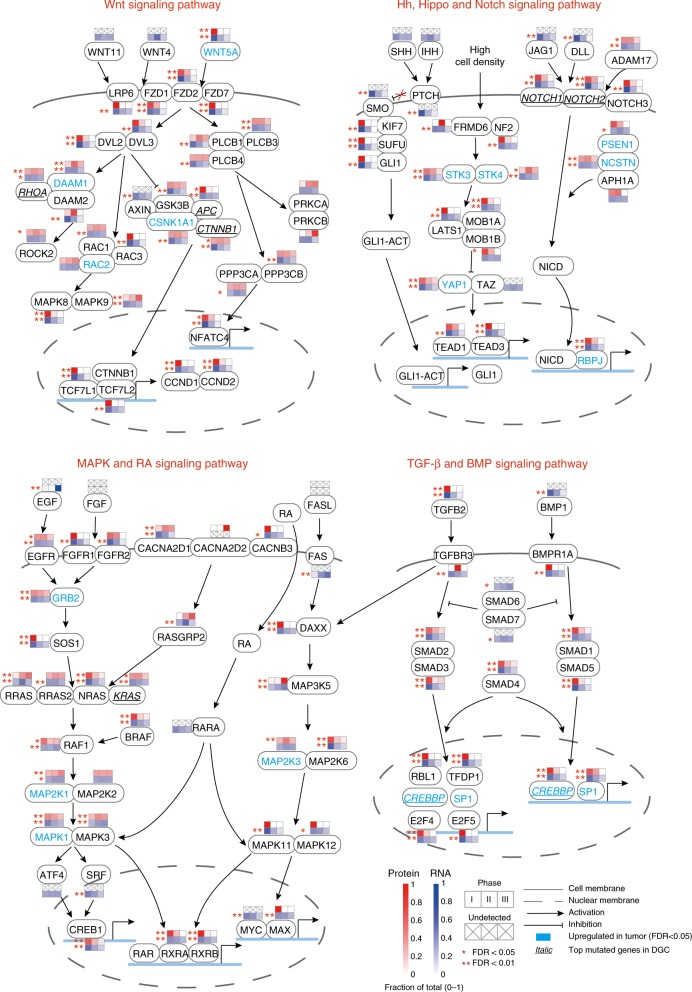
图 6 涉及胃发育和胃癌的关键信号通路
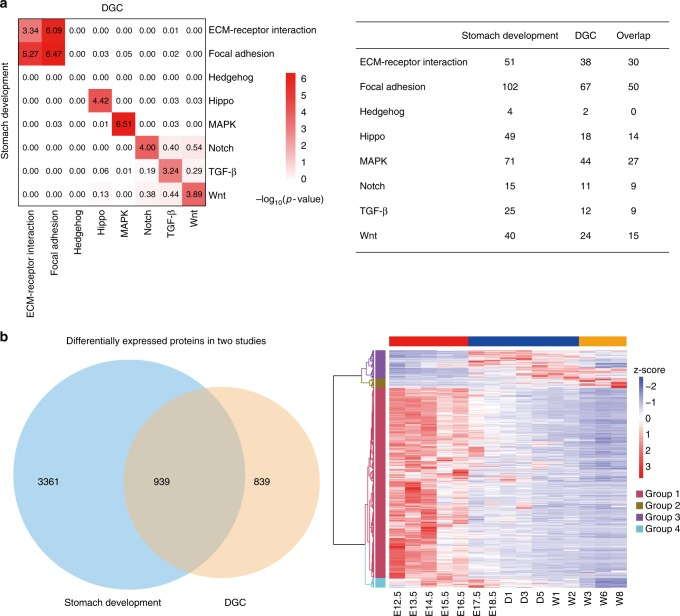
图7 胃发育与胃癌相关性分析
文章小结
作者描绘了小鼠胃发育过程蛋白质和 mRNA 水平全景图,确定了胃发育过程中三个不同阶段。将蛋白质组学和转录组学数据结合在一起,检测和验证可能对胃发育有根本影响的可变剪接转录本。通过比较胃发育的蛋白质组学特征与弥漫型胃癌的蛋白质组学特征,发现显著数量的途径调节因子,特别是在DGC中上调或经常突变的转录因子,在胃发育期间也差异表达,证明了胃癌和胃发育之间存在相关性。
解析文献
Xianju Li, Chunchao Zhang, et al. A time-resolved multi-omic atlas of the developing mouse stomach[J]. Nature Communications, 2018, 9:4910.
相关服务
Label-free是通过比较质谱分析次数或质谱峰强度,分析不同来源样品蛋白的数量变化,认为肽段在质谱中被捕获检测的频率与其在混合物中的丰度成正相关。Label-free定量不需要对比较样本做特定标记处理,只需要比较特定肽段/蛋白在不同样品间的色谱质谱响应信号便可得到样品间蛋白表达量的变化,通常用于分析大规模蛋白鉴定和定量时所产生的质谱数据。
金开瑞提供的Label-free定量蛋白质组技术服务,已助力客户文献发表多篇文章,影响因子高达20+!
上一条:引物合成的步骤及方法介绍
下一条:如何分离纯化、鉴定外泌体
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










