长链非编码RNA LINC00473通过分泌microRNA-195-5p上调PD-L1促进胰腺癌进展
信息来源:金开瑞 作者:genecreate 发布时间:2019-07-26 09:00:23
题目:Long noncoding RNA LINC00473 drives the progression of pancreatic cancer via upregulating programmed death-ligand 1 by sponging microRNA-195-5p.
期刊:J Cell Physiol(IF= 4.522)
主要技术:双荧光素酶实验、AGO2-RIP、RNA pulldown
研究背景
胰腺癌(Pancreatic cancer ,PC)被认为是致命的恶性肿瘤,伴随着高死亡率和不良预后,其在全世界日益成为严重的健康负担。虽然手术,化疗和放射治疗可以轻度缓解PC患者的症状,但由于缺乏有效的诊断标志物在初始阶段监测PC及预测预后,PC仍然面临不令人满意的临床结果。因此,迫切需要寻找其他可能的PC治疗方法。最近,程序性死亡配体1(PD-L1),已被用于肿瘤治疗,作为多种肿瘤的治疗靶点,尤其是PC。PD-L1充当T细胞活化的负调节分子,通过与PD-1的互做,改变免疫监视状态从而介导肿瘤进展。在临床结果不佳的PC患者中报告了PD-L1的过度表达。已经证明几种非编码RNA可以下调PD-L1,从而提高靶向治疗的治疗效果。因此,该研究旨在研究lncRNA、miRNA在PC进展中潜在的分子机制。
研究内容及结果
1. LINC00473 与PD-L1在PC中上调,miR-195-5p在PC中下调,并且PD-L1的高表达与预后不良有关
作者首先检测了134例PC组织及20例正常胰腺组织,通过IHC发现PD-L1主要表达在细胞膜上,PC组织中PD-L1阳性率(57.69%)显著高于正常胰腺组织(23.53%,p <0.05;图1)。此外,临床病理资料分析显示,PD-L1阳性表达与肿瘤分期、肿瘤大小、LNM和远处转移密切相关(p <0.05),而与与年龄、性别、神经周围侵犯及肿瘤分化无关。随后,对85例PD-L1阳性及49例PD-L1阴性患者进行Kaplan-Meier生存分析,发现PD-L1阳性的PC患者的总体存活期比PD-L1阴性的患者短(p <0.05;图2),提示高表达的PD-L1与不良预后相关。
随后,对于PC组织及正常组织中的LINC00473、PD-L1及miR-195-5p表达进行了检测,发现相较于正常组织,LINC00473、PD-L1表达上调,而miR-195-5p表达下调(图3a、b、c)。此外,作者还在正常胰腺细胞系H6C7及PC细胞系SW-1990、Panc-1、BxPC-3、AsPC-1及CAPAN-2检测了LINC00473的表达,发现相较于H6C7,LINC0047在所有PC细胞系中均表达较高,且在SW-1990中表达最高(图3d),因此后续也选用SW-1990细胞系开展机制研究。
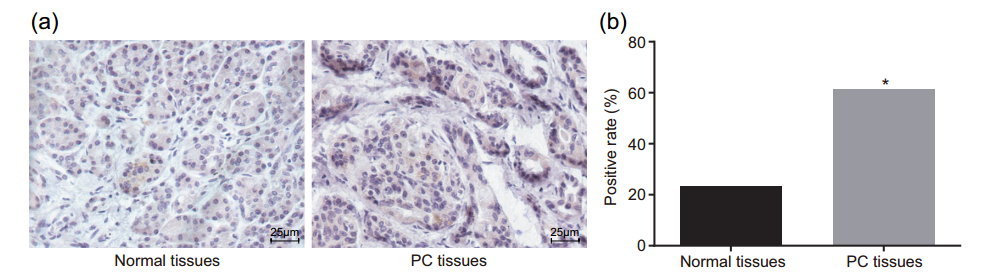
图1 PD-L1在PC组织中高表达
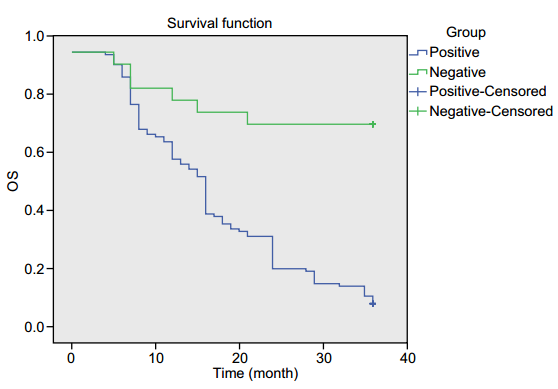
图2 PD-L1高表达与PC患者总体生存率低下相关
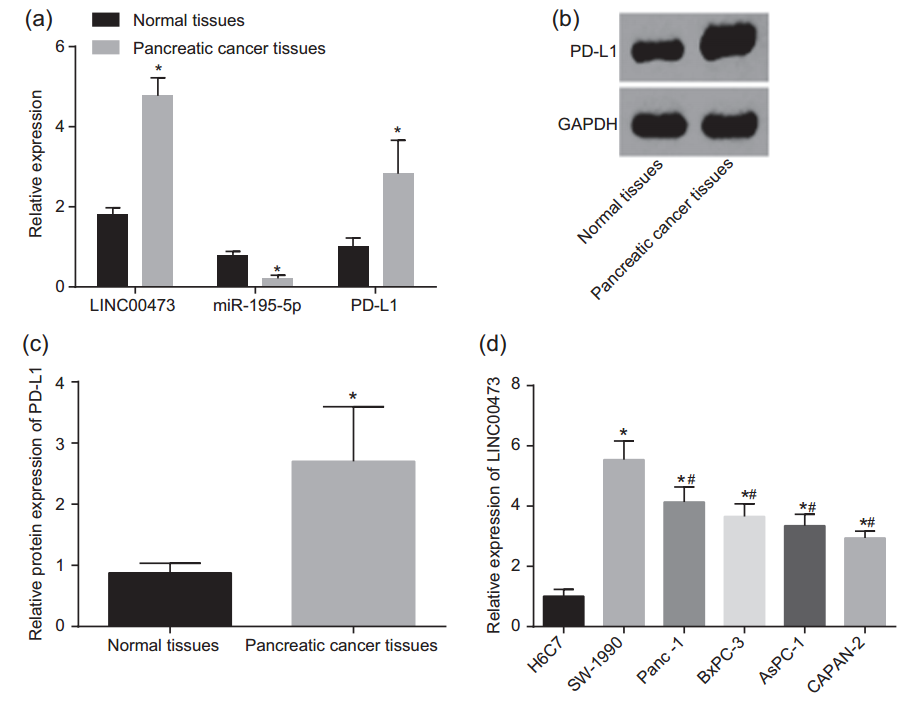
图3 LINC00473 与PD-L1在PC中上调,miR-195-5p在PC中下调
2. miR-195-5p可以靶向调控PD-L1的表达,过表达miR-195-5p可以通过下调PD-L1表达抑制PC进展
通过生物信息学预测可以发现,miR-195-5p和PD-L1存在可能的互作位点(图4a)。随后通过双荧光素酶实验发现野生型的PD-L1序列组通过mimics过表达miR-195-5p后荧光强度下降;而将预测到的miR-195-5p和PD-L1结合位点突变之后荧光强度恢复到对照组水平,说明miR-195-5p和PD-L1的确可能通过该位点发生互作(图4b)。加入miR-195-5p mimics后可以发现PD-L1的mRNA及蛋白水平均出现了下降,和加入PD-L1的抑制剂Atezolizumab后的情况类似(图4c、d、e)。上述实验说明miR-195-5p可以靶向下调PD-L1的表达。
接着,分别采用EdU染色、TUNEL染色、细胞划痕和transwell实验检测了miR-195-5p对SW-1990肿瘤生物学指标的影响,发现miR-195-5p过表达可以抑制细胞增殖(图5a、b),增加细胞凋亡(图5c、d),降低细胞迁移和侵袭能力(图5e、f、g、h)。同时,miR-195-5p过表达还可以调控凋亡相关蛋白BCL-2、Bax,细胞迁移侵袭相关蛋白MMP2、MMP9(图5i、j、k)。对上述因子的调控均和PD-L1抑制剂Atezolizumab的效果一致,说明miR-95-5p可能通过下调PD-L1表达抑制PC进展。
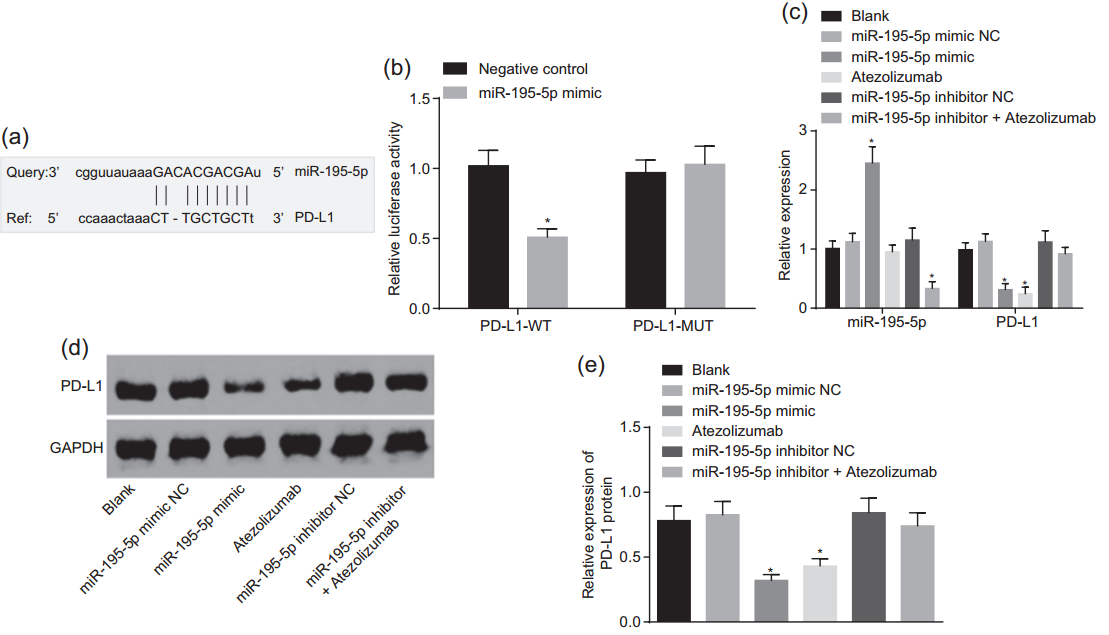
图4 miR-95-5p靶向下调PD-L1的表达
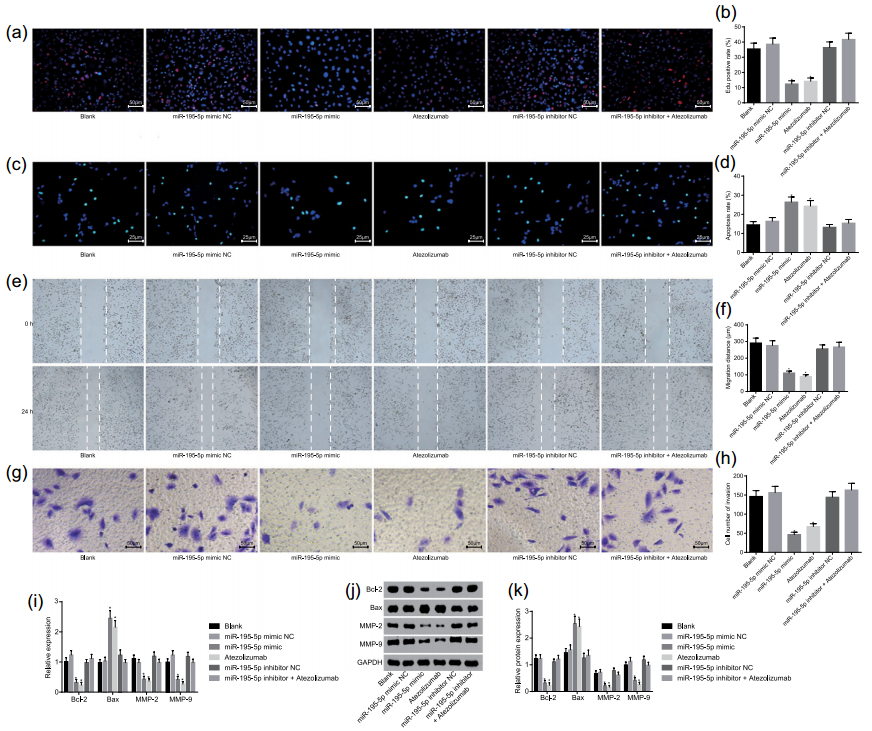
图5 miR-95-5p可以通过下调PD-L1表达抑制PC进展
3. LINC00437可以miR-159-5p的ceRNA形式上调PD-L1表达,而当LINC00437表达下调时PC进展亦受抑制
原位荧光杂交显示LINC00437主要定位在细胞质(图6),提示其作为ceRNA的可能。随后采用生物信息学预测,发现了LINC00437与miR-159-5p潜在的结合位点(图7a)。在采用双荧光素酶实验证实LINC00437和miR-159-5p的确可能在上述位点发生互作后,作者接下来分别采用AGO2-RIP与RNA pulldown确定了LINC00437和miR-159-5p的互作关系。当干扰LINC00437表达后,miR-159-5p表达显著上升,PD-L1表达显著下降;而当同时干扰LINC00437与miR-159-5p后,PD-L1的表达恢复到对照组水平。PD-L1蛋白的表达也存在同样趋势。上述实验说明LINC00437可以结合并调控miR-159-5p,并通过其调控PD-L1的表达。
继续分别采用EdU染色、TUNEL染色、细胞划痕和transwell实验检测LINC00437对SW-1990细胞肿瘤生物学指标的影响,发现干扰LINC00437过表达可以抑制细胞增殖(图8a、b),增加细胞凋亡(图8c、d),降低细胞迁移和侵袭能力(图8e、f、g、h)。同时,LINC00437低表达还可以调控凋亡相关蛋白BCL-2、Bax,细胞迁移侵袭相关蛋白MMP2、MMP9(图8i、j、k)。同时,挽救实验也证实同时干扰LINC00437与miR-159-5p表达后细胞肿瘤生物学指标得到回复,说明LINC00437对细胞肿瘤进程的影响是通过miR-159-5p介导的。
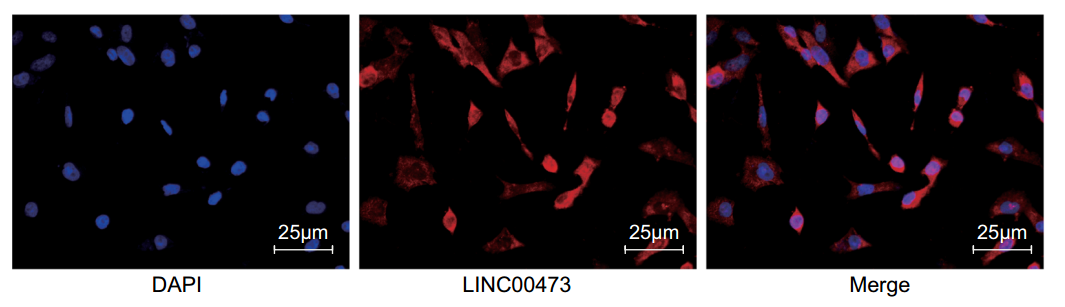
图6 LINC00437主要定位在细胞质
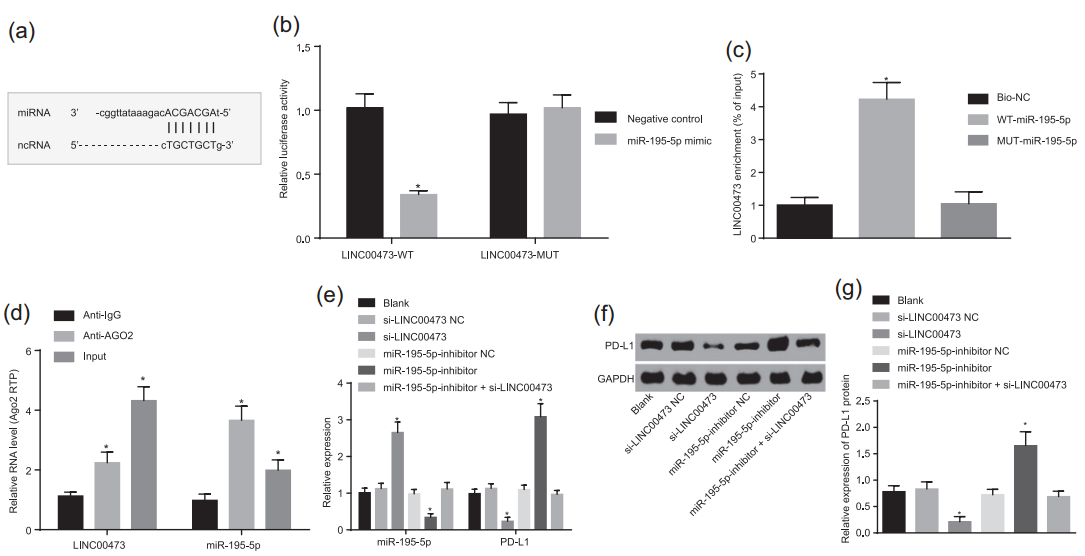
图7 LINC00437可以ceRNA形式通过miR-159-5p调控PD-L1的表达
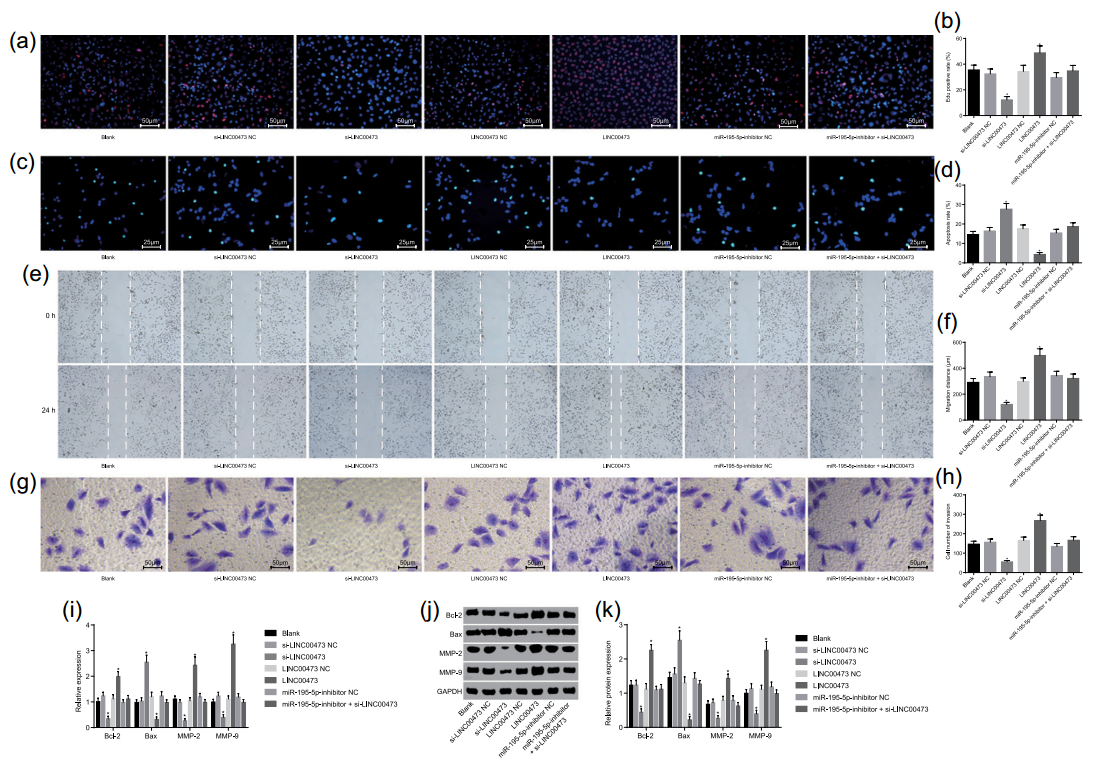
图8 LINC00437低表达可以抑制PC进展
4. LINC00473可通过吸附miR-195-5p调控PD-L1表达,从而影响CD8+细胞活化
在SW-1990细胞中干扰LINC00473及miR-195-5p后,将这些细胞与CD8+细胞共孵育,随后采用ELISA检测了细胞培养上清中细胞因子的含量,发现干扰LINC00473表达组可导致促瘤细胞因子IL-10浓度下降,抑瘤细胞因子IFN-γ与IL-4浓度上升;而同时干扰LINC00473与miR-195-5p组上述细胞因子浓度均回归到对照组水平(图9a)。继续检测共培养处理后的CD8+细胞发现,干扰LINC00473表达组CD8+细胞凋亡减少,PD-1及PD-L1表达减少;同时干扰LINC00473与miR-195-5p组CD8+细胞凋亡水平及PD-1、PD-L1表达水平与对照组相当;过表达LINC00473组CD8+细胞凋亡水平上升,PD-1及PD-L1表达增加(图9)。
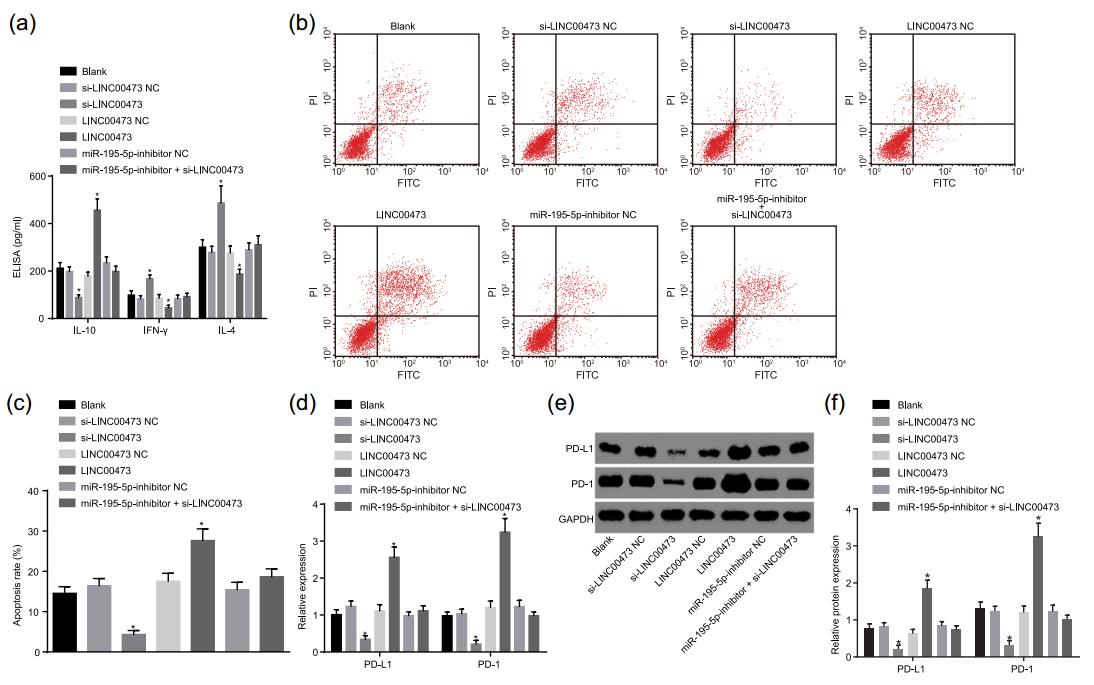
图9 LINC00473过表达影响CD8+细胞活化
文章小结
在PC细胞中,LINC00473作为结合miR-195-5p的ceRNA发挥功能,上调PD-L1及其受体PD-1,从而抑制CD8+ T细胞活化并促进PC的进展;LINC00473沉默或过表达miR-195-5p过下调PD-L1及其受体PD-1抑制细胞增殖,迁移和侵袭,促进PC的细胞凋亡,从而防止PC的发生。
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图











