肠道菌群(GM)来源细胞外囊泡(bEVs)的研究进展
1、细菌外泌体(bEVs)简介
细胞外囊泡(extracellular vesicles,EVs)是一类由细胞膜脱落或细胞分泌而成的双层膜囊泡结构,其生成和释放是一种广泛存在于自然界中的现象。无论是哺乳动物细胞、植物还是细菌,都能释放出大小相近的外泌体,通常在20~400nm之间。外泌体内含有丰富的蛋白质、核酸、脂质以及其他代谢产物,对于细胞或细菌的种内和种间的这种跨界交流中都起着十分重要的作用[1-2]。此外,由于外泌体具有靶向性、生物相容性以及能够穿过血脑屏障等优点,也使之成为当前研究的热点之一[3-4]。
细菌来源外囊泡(bacterial extracellular vesicles, bEVs)是肠道内的各种菌群分泌的一种功能性纳米囊泡,其中包含来自亲本菌的各种生物分子。根据其来源的亲本的不同,我们将它分为以下两类(如下图):其中来自革兰氏阴性菌的 bEV,称为外膜囊泡 (outer membrane vesicles, OMVs),起源于外膜并携带来自周质和细胞质成分,直径为 20-250 nm。来自革兰氏阳性细菌的 bEV,称为细胞质膜囊泡 (cytoplasmic membrane vesicles,CMVs),来源于细胞质膜并携带来自细胞质的物质,直径为 20-400 nm[5]。
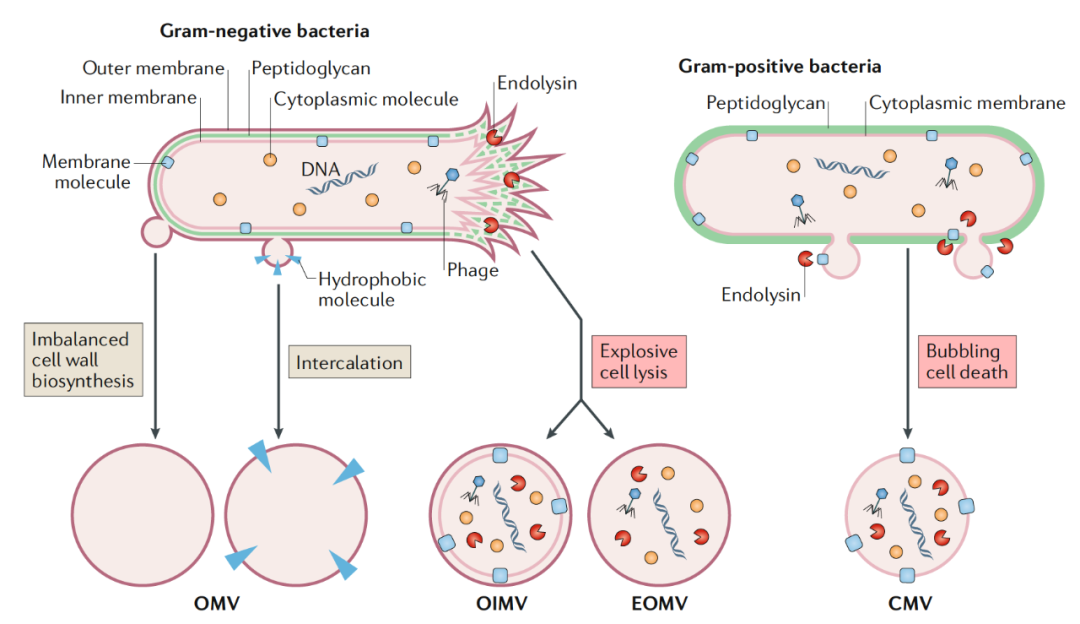
不同的途径导致形成不同的膜囊泡类型[5]
2、GM来源外囊泡的研究意义
肠道菌群分泌的细胞外囊泡,被称为bEVs,在肠道微生态系统中扮演着关键的角色。这些囊泡携带着丰富的分子成分,包括蛋白质、核酸和脂质等,促进了微生物之间的相互作用和宿主-微生物之间的沟通,从而影响到免疫调节、代谢调控等重要的生理过程。
同时,这些囊泡可能在肠道疾病的发展中发挥作用,例如炎症性肠病等[6]。通过分析bEVs中的分子组成,我们可以了解肠道菌群的状态和宿主的健康状况,为疾病诊断和预防提供有价值的信息。此外,肠道菌群来源外囊泡的研究也为发展新的治疗策略提供了可能性,通过深入研究囊泡内携带的分子成分及其功能,我们可以揭示微生物-宿主之间相互作用的机制,从而探索出一些可以用来干预微生物群落与宿主之间相互影响的方法,为个体化医疗提供创新途径。
总之,肠道菌群来源外囊泡的研究不仅有助于深化我们对肠道微生态系统的理解,同时还为我们提供了新的思路和方法,以解析肠道健康与疾病之间的关系[7]。
3、肠道菌群(GM)分泌的bEVs的研究进展
今天小金就给大家分享最近看的几篇有关肠道(GM)来源的bEVs在相关疾病发生、发展以及治疗上的研究文章:
文献1:来源于具核梭杆菌感染的肠上皮细胞的外泌体miR-129-2-3p通过调节TIMELESS介导的细胞衰老途径促进实验性结肠炎[8]
溃疡性结肠炎(UC)是一种与克罗恩病(CD)不同的炎症性肠病(IBD),其主要特征是结肠和直肠的弥漫性、浅表性炎症。值得注意的是,UC随着时间的推移会增加疾病进展的风险,例如增加住院、肿瘤发展和其他肠外并发症的风险。UC可能由多种因素引起,包括肠道菌群失调、遗传背景、黏膜免疫失调和环境,但UC的确切病因至今仍不清楚。

来源: Wei,Shuchun, et al. Gut Microbes.[8]
武汉大学人民医院董卫国教授课题组通过miRNA测序鉴定了感染Fn的肠上皮细胞衍生的外泌体Fn-Exo和非感染Fn的肠上皮细胞衍生的外泌体(Con-Exo)中差异表达的miRNA。然后,在体外和体内研究了Fn-Exo在UC发展中的生物学作用和机制。
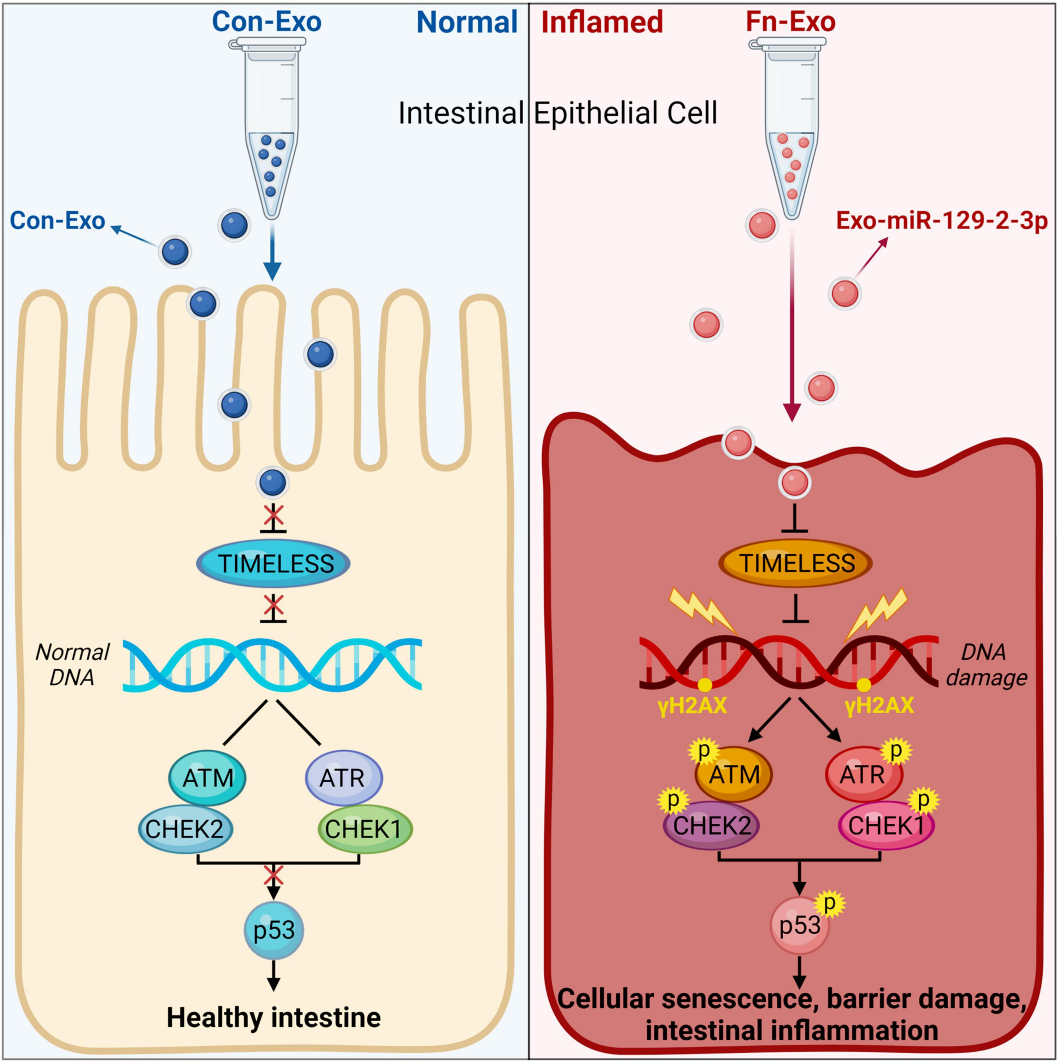
来源: Wei,Shuchun, et al. Gut Microbes.[8]
研究发现,外泌体可以将miR-129-2-3p从感染Fn的肠上皮细胞传递至未感染Fn的肠上皮细胞中,加剧上皮屏障功能障碍和结肠炎症。机制上,Fn-Exo通过miR-129-2-3p/TIMELESS轴诱导DNA损伤,随后激活ATM/ATR/p53信号通路,最终促进细胞衰老和结肠炎症。
总之,Exo-miR-129-2-3p/TIMELESS/ATM/ATR/p53通路促进了细胞衰老,加重了屏障损伤和结肠炎。此外,TIMELESS和血清中的Exo-miR-129-2-3p可能作为UC(尤其是感染Fn的UC)的新型潜在诊断生物标志物。
该研究揭示了具核梭杆菌(Fusobacterium nucleatum,Fn)通过外泌体加重溃疡性结肠炎(UC)的分子机制,为UC的诊断和靶向治疗提供了新的理论基础。
上述结果于2023年8月7日,来自中国武汉大学人民医院董卫国教授课题组及其团队在Gut Microbes (IF: 12.2 )杂志上发表名为Exosomal-miR-129-2-3p derived from Fusobacterium nucleatum-infected intestinal epithelial cells promotes experimental colitis through regulating TIMELESS-mediated cellular senescence pathway的研究[8]。
文献2:粪便来源的细胞外囊泡参与了导致肝脏疾病的屏障功能障碍[9]
非酒精性脂肪性肝病 (NAFLD)是目前公认的主要慢性肝病,在全球范围内的患病率为25%。NAFLD的特征是存在脂肪变性,从而导致脂肪毒性。肝脏脂毒性先于肝脏炎症,并增加出现不可逆非酒精性脂肪性肝炎 (NASH)的易感性。NASH与纤维化生成相关,导致肝功能损害和疾病加重。在这方面,NASH可在21%~26%的病例中导致肝硬化,在2.6%和12.8%的病例中可能演变为肝细胞癌。

来源: Fizanne, Lionel, et al. J Extracell Vesicles[9]
来自法国安格斯大学的Lionel Fizanne及其团队通过差速离心分离、纯化了健康供体、NAFLD和NASH患者的粪便样本来源的细胞外囊泡(fEVs)。并探究了EVs在体外(肠细胞、内皮细胞、枯否细胞和星状细胞)中的作用以及体内非肌肉肌轻链激酶(nmMLCK)缺陷小鼠模型中发挥的功能。最后再通过16s rDNA基因测序分析fEVs的细菌起源。
研究结果表明,fEVs和小的cEVs都由原核和真核起源组成。然而,只有NASH-fEVs具有有害影响。NASH-fEVs能够增加肠道通透性,减少紧密连接蛋白的表达,这种影响可以通过抑制nmMLCK来预防。此外,NASH-fEVs还会增加内皮细胞的通透性,并引发炎症细胞因子和趋化因子的释放,这一过程需要TLR4/脂多糖途径的参与。
同时,NASH-fEVs和NASH-cEVs还会激活肝星形细胞的纤维化和炎症蛋白。使用NASH-fEVs治疗能够增加野生型小鼠的肠道通透性,但不能增加nmMLCK缺陷小鼠的肠道通透性。此外,fEVs的细菌起源在NAFLD和NASH患者之间是不同的,而且16s扩增子序列变异在不同的人群中丰度也不同。这项研究表明,fEVs在导致肝脏损伤的屏障功能障碍中发挥着积极作用,并强调了nmMLCK和fEVs携带的脂多糖的作用。
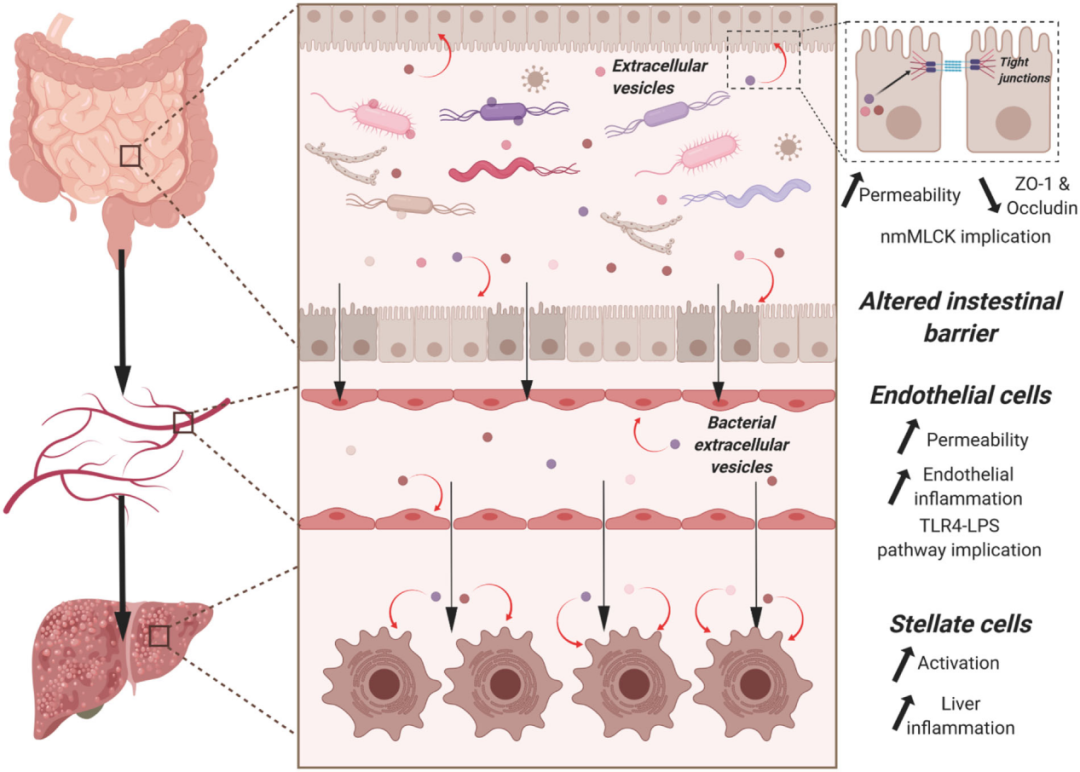
来源: Fizanne, Lionel, et al. J Extracell Vesicles[9]
相关研究结果于2023年1月28日,由来自法国安格斯大学的Lionel Fizanne及其团队在J Extracell Vesicles (IF: 17.337)杂志上发表名为Faeces-derived extracellular vesicles participate in the onset of barrier dysfunction leading to liver diseases的研究[9]。
文献3:儿童肠道菌群通过释放胞外囊泡到骨组织中来保持骨量和强度[10]
骨质疏松症(osteoporosis)是由于多种原因导致的骨密度和骨质量下降,骨微结构破坏,造成骨脆性增加,从而容易发生骨折的全身性骨病。目前,我国骨质疏松症患者已超过8000万,居全球之首,其中大多数为绝经后女性。由于它早期没有明显症状,很容易被人们忽视,存在很大的危害。因此,需要更多理想的干预措施来改善骨骼健康和预防骨质疏松症。

来源: Liu J H, et al. Advanced Science[10]
在这里,来自中南大学湘雅医院的谢辉研究团队通过将来自健康儿童的GM(CGM)和来自老年人的GM(EGM)定植到卵巢切除术(OVX)诱导的骨质疏松小鼠中,评估了GM对骨量和骨强度的影响。
同时,通过使用16S rRNA基因测序分析CGM和EGM样本,确定了它们微生物组成的差异。此外,作者还通过直接补充嗜黏蛋白阿克曼菌(Akk)来研究其对OVX诱导的骨代谢不平衡和骨质疏松的影响。作者还研究了细胞外囊泡(EVs)在CGM和Akk诱导的骨保护效应中的作用,包括EVs的分泌、进入骨组织和对骨细胞的影响。
结果发现:来自儿童肠道菌群(CGM)的移植阻止了常规饲养的卵巢切除(OVX)诱导的骨质疏松小鼠骨量和骨强度的下降。16S rRNA基因测序表明,儿童肠道菌群逆转了卵巢切除诱导的嗜黏蛋白阿克曼菌(Akkermansia muciniphila,Akk菌)的减少。直接补充Akk足以纠正卵巢切除引起的骨代谢失衡,并防止骨质疏松。
儿童肠道菌群和Akk分泌的细胞外囊泡(EVs)在发挥的骨保护作用中起到关键作用,这些囊泡可以进入和积累到骨组织中,通过增强成骨活性和抑制破骨细胞的形成来减弱卵巢切除诱导的骨质疏松表型。该研究为肠道菌群与宿主骨之间的信号交换提供了一种新的潜在机制。
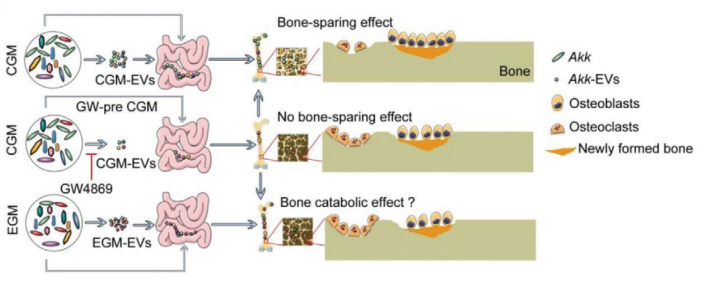
来源: Liu J H, et al. Advanced Science[10]
2021年2月17日, 来自中国湖南中南大学湘雅医院谢辉实验室在国际期刊Advanced Science(IF: 15.1)杂志上发表名为Extracellular vesicles from child gut microbiota enter into bone to preserve bone mass and strength的研究论文[10]。
小结
肠道菌群外泌体研究具有广阔的前景。肠道菌群是人体内重要的微生态系统,其与健康密切相关。近年来,发现肠道菌群通过释放外泌体来进行细胞间通信,这为新的研究方向提供了机会。这些外泌体可能在肠道微生物与宿主之间的相互作用、免疫调节等方面起重要作用。
因此,深入探究肠道菌群外泌体的组成、功能和机制,有望揭示肠道微生物与宿主健康之间的深层联系,为肠道疾病、免疫调节以及个性化医疗提供新的认识和方法。此外,肠道菌群外泌体也可能成为诊断疾病、开发新药物和生物治疗的潜在来源。
综上所述,肠道菌群外泌体研究前景光明,将在生命科学、医学和微生物生态学领域带来重要突破。
参考文献:
[1] Kalluri R, LeBleu V S. The biology, function, and biomedical applications of exosomes[J]. Science, 2020, 367(6478).
[2] Liu D, Sun H, Sheng G, et al. Recent advances in the source and biological function of bacterial DNA in extracellular vesicles[J]. Chinese Journal of Antituberculosis, 2023, 45(7): 693.
[3] van Niel G, Carter D R F, Clayton A, et al. Challenges and directions in studying cell–cell communication by extracellular vesicles[J]. Nature Reviews Molecular Cell Biology, 2022, 23(5): 369-382.
[4] Celik P A, Derkus B, Erdogan K, et al. Bacterial membrane vesicle functions, laboratory methods, and applications[J]. Biotechnology Advances, 2022, 54: 107869.
[5] Toyofuku, Masanori, Nobuhiko Nomura, and Leo Eberl. "Types and origins of bacterial membrane vesicles." Nature Reviews Microbiology 17.1 (2019): 13-24.
[6] Chen S Z, Chen Y. The role of intestinal bacteria derived extracellular vesicles in inflammatory bowel disease[J]. Zhonghua nei ke za zhi, 2021, 60(10): 932-936.
[7] Díaz‐Garrido, Natalia, Josefa Badia, and Laura Baldomà. "Microbiota‐derived extracellular vesicles in interkingdom communication in the gut." Journal of Extracellular Vesicles 10.13 (2021): e12161.
[8] Wei,Shuchun, et al. "Exosomal-miR-129-2-3p derived from Fusobacterium nucleatum-infected intestinal epithelial cells promotes experimental colitis through regulating TIMELESS-mediated cellular senescence pathway." Gut Microbes 15.1 (2023): 2240035.
[9] Fizanne, Lionel, et al. "Faeces‐derived extracellular vesicles participate in the onset of barrier dysfunction leading to liver diseases." Journal of Extracellular Vesicles 12.2 (2023): 12303.
[10] Liu J H, Chen C Y, Liu Z Z, et al. Extracellular vesicles from child gut microbiota enter into bone to preserve bone mass and strength[J]. Advanced Science, 2021, 8(9): 2004831.

最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










