蛋白互作研究利器:Co-IP实验的核心要点
免疫共沉淀技术(co-Immunoprecipitation,Co-IP)是一种研究两种蛋白在体内是否存在相互作用的有效方法。
一、实验原理
免疫沉淀是利用抗体特异性反应纯化富集目的蛋白的一种方法。抗体与细胞裂解液或表达上清中相应的蛋白结合后,再与蛋白A/G(Protein A/G)偶联的agarose或Sepharose珠子孵育,通过离心得到珠子-蛋白A/G-抗体-目的蛋白复合物,在高温及还原剂的作用下,抗原与抗体解离,收集上清,上清中包括抗体、目的蛋白和少量的杂蛋白。
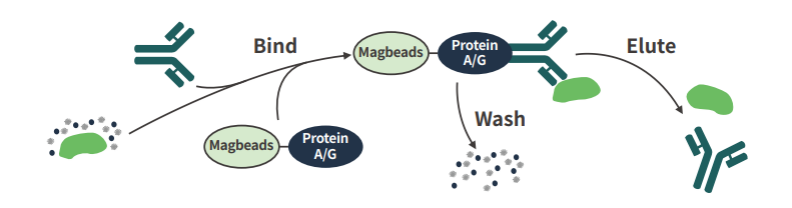
图1.CO-IP实验原理
二、IP、Co-IP、ChIP和RIP的区别
不同类型的分子互作(如蛋白-蛋白、蛋白-DNA、蛋白-RNA)具有高度特异性,仅凭单一技术难以全面解析。IP(免疫沉淀)、Co-IP(共免疫沉淀)、ChIP(染色质免疫沉淀)和RIP(RNA免疫沉淀) 作为分子互作研究的四大基石技术,分别针对不同维度的相互作用设计。若混淆其应用场景,轻则导致实验失败,重则产生误导性结论——例如,用IP验证蛋白互作可能遗漏关键结合伙伴,而误用ChIP研究RNA结合蛋白则会完全偏离目标。因此,精准区分四者的原理与适用范围,不仅是实验设计的首要前提,更是确保数据可靠性和科学价值的关键。
|
实验类型 |
原理 |
主要应用 |
关键区别 |
|
IP |
是利用抗原抗体特异性反应纯化富集样品中目的蛋白。 |
-鉴定特定蛋白的存在和表达水平, 检测蛋白翻译后修饰(如磷酸化、泛素化); |
侧重于蛋白符合物研究;适用于蛋白纯化或修饰研究。 |
|
Co-IP |
在IP基础上捕获与靶蛋白直接/间接结合的互作蛋白,验证蛋白复合物。 |
验证蛋白质相互作用; |
需验证互作蛋白,需设置阴性对照(如IgG);适用于生理条件下的蛋白互作验证。 |
|
ChIP |
甲醛交联固定DNA-蛋白复合物,超声打断染色质后,用抗体富集靶蛋白结合的DNA片段。 |
鉴定转录因子结合位点; |
检测DNA与蛋白结合,需交联和DNA纯化;适用于基因调控研究。 |
|
RIP |
利用抗体捕获RNA结合蛋白(RBP),分离与其结合的RNA分子。 |
分析RNA结合蛋白功能;非编码RNA功能机制研究。 |
检测RNA与蛋白结合,需抑制RNase活性;适用于RNA功能或调控网络分析。 |
三、Co-IP实验流程简介
1. 样品制备
裂解细胞/组织:使用含蛋白酶抑制剂的RIPA裂解液(建议冰上操作)。
离心去除碎片:12,000×g离心10分钟,取上清作为总蛋白样品。
★注意:蛋白提取整个过程都在冰上操作,减少高温造成的蛋白降解;超声过程中最好不要有气泡产生,减少蛋白降解。裂解后的总蛋白放在-20℃保存。
2. 抗体-磁珠孵育
预清洗磁珠:用裂解液洗涤Protein A/G磁珠,去除保存液。
抗体结合:加入靶蛋白抗体,4℃旋转孵育1-2小时(或过夜)。
★注意:抗体选择经过IP验证的,可减少假阳性概率。同时要注意抗体/缓冲液的比例,抗体稀释过度不利于后续抗原抗体结合;而抗体过多就不能完全沉降在固相基质上,残存于上清。
3. 抗原捕获
加入总蛋白样品:与抗体-磁珠复合物4℃旋转孵育4小时。
阴性对照:平行设置同型IgG抗体对照组。
4. 洗涤与洗脱
洗涤步骤:用预冷裂解液洗涤3-4次,去除非特异性结合。
蛋白洗脱:加入SDS上样缓冲液,95℃加热10分钟,离心取上清。
5. 结果检测
Western Blot:用目标蛋白B的抗体检测洗脱样品。
数据分析:对比实验组与对照组的条带差异,验证相互作用。
★注意:增加在洗脱之前的洗涤次数或在免疫共沉淀缓冲液中加入 Triton X-100 ,可以降低非特异性结合,以防止蛋白在阴性对照树脂实验样品中被检测到。
四、Co-IP实验注意事项
1.抗体选择
使用已验证特异性的抗体,避免交叉反应。
实验组与检测抗体避免使用同一物种来源(防止二抗干扰)。
2.裂解条件优化
裂解液成分:NP-40浓度建议0.1%-1%,过高会破坏天然复合物。
避免反复冻融样品,防止蛋白降解。
3.对照设置
必须包含:阴性对照(IgG)、阳性对照(已知互作蛋白)、Input对照。
4.操作细节
全程低温操作(冰盒或冷室)。
洗涤时轻柔吹打,避免磁珠损失。
离心转速不超过3000×g,防止复合物解离。
5.结果解读
需排除假阳性:如蛋白间非特异性结合或抗体交叉反应。
建议结合GST pull-down等互补实验验证。
五、结果解读
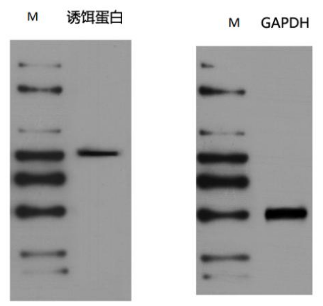
图2. IP前WB质控(CoIP、ChIP和RIP都需要进行WB)
❖在正式实验前,务必要对样品做WB质控;
❖IP前WB检测的指标应至少包括诱饵蛋白以及内参蛋白,如果有预期的猎物蛋白,也应在IP前检测本底表达水平;
❖内参蛋白条带必须清晰无拖带,如果内参条带不正常,说明样本内蛋白已经发生降解,需要重新备样;
❖诱饵或猎物蛋白条带最好是强信号的单带,如果信号比较弱,IP后可能检测不到信号,导致实验失败,或误判成假阴性结果,建议在样本中过表达目的蛋白后再做尝试;
❖诱饵蛋白WB如果杂带较多,可能是该批次抗体在该样本中的特异性不够好,如果实在没有合适的抗体,也至少应当在目的条带的信号相较于杂带足够强的前提下,再进行后续实验,否则无法保证最终结果的可靠性。
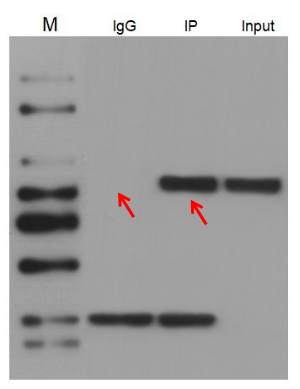
图3. IP后WB
1.一次完整严谨的CoIP实验,应当包含IgG对照组、IP实验组以及Input组;
2. Input泳道所点样本与IP前WB一致,作为阳性对照;
3. 判定CoIP实验成功的标准,是能够在IP泳道检测到诱饵蛋白信号,且IgG泳道检测不到;如果IgG泳道也检测到诱饵蛋白,说明该蛋白能够与所有IgG类的抗体结合,只能换别的实验如酵母杂交、GST pulldown等来验证。
4.在IP后能够检测到诱饵蛋白的前提下,如果检测不到猎物蛋白,说明两个蛋白不互作,至少在这个样本和实验体系下不互作,并不代表实验本身有问题;
5.CoIP后往往会在IgG和IP泳道出现目的条带以外的杂带,这是由于CoIP实验会往实验体系中加入抗体进行富集,这些抗体最终也会也会被WB的二抗识别到;
6.抗体由轻链和重链构成,轻链分子量约为25KD,重链分子量约为50-70KD,如图3所示,由于使用了识别轻链的二抗,因此IgG和IP泳道均在25KD左右出现了抗体链条带;
7.在做IP后WB时,为了避免抗体链对结果的干扰,应灵活选择二抗,如左图所示,由于目的条带在重链范围,因此选择了识别轻链的二抗。
六、常见问题与解决方案
Q:IgG组及IP组均检测到目的条带,为什么?
A:Co-IP WB鉴定结果IgG组无目的蛋白条带、IP组有目的蛋白条带,说明IP过程成功,此时质谱极低概率会在IgG组中鉴定到目的条带,如果遇到这种情况可能是在切胶及质谱样品处理过程中发生了串染,对IP组中互作蛋白的结论没有影响,IgG组中的蛋白在文章中通常都不是考察对象。
Q:IP后WB鉴定到目的蛋白,质谱未鉴定到,为什么?
A:IP后WB检测到目的蛋白条带,说明IP过程成功。我们从自身技术流程步骤做排查,确保相关质控均合格,通过标准品检测质谱当时的状态正常,保证技术流程及质谱性能均无问题。如果确实质谱未发现目的蛋白,通常是由于蛋白本身在样品中相对丰度较低导致,由于质谱过程中其他相对高丰度的蛋白可能掩盖部分信号、导致样品中低丰度蛋白未被鉴定。
Q:Co-IP实验成功的评判标准?
A:在 Co-IP-WB鉴定结果中,IgG组无目的蛋白条带、IP组有目的蛋白条带,说明IP过程成功;银染胶图中,IP组相对于IgG组有更多蛋白条带、且存在差异,说明 Co-IP过程捕获到互作蛋白;IP产物在质谱检测中鉴定到的蛋白数量不能作为判断实验成败的标准,因为这取决于目的蛋白本身所具有的互作蛋白数量、结合力强弱等方面;IP产物的质谱鉴定数量越多并不代表结果越好。
Q:Co-IP需要准备多于多少样本量?
A:是的。Co-IP实验需要保证足够的蛋白浓度才能维持原本存在的蛋白互作状态,尤其当蛋白丰度较低、相互作用力不强、使用不易提蛋白组织等情况时。而且 Co-IP的实验条件往往需要反复摸索。因此用于 Co-IP实验需准备细胞>2x107,动物组织>500mg,植物组织>2g,并且须更加注意采集后速冻-80℃保存和避免反复冻融。
Q:Co-IP实验成败的主要因素?
A:a.所使用的抗体不仅需要优秀的亲和力、特异性,其识别表位还可能被互作蛋白所掩蔽(主要是使用单抗时);
b.当蛋白互作须发生在特定生理代谢条件、组织细胞类型之中时, Co-IP实验可能无法获得互作结果;
c.如果诱饵蛋白和或捕获蛋白在样本中丰度很低时;
d.两个互作蛋白的亲和力较弱;
e.当该蛋白互作需要较特定的离子强度,或者需要如Ca离子/Mg离子/ATP等辅因子时,要创造合适的反应条件会变得困难;
f.一些样品处理提取存在难度,提取足量目的蛋白与保持蛋白天然状态,需通过实验条件达到优化平衡;
g.外源表达的标签蛋白存在同内源蛋白的位点竞争,这主要在使用标签抗体进行实验时可能存在。
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










