RNA pull down技术实验的应用场景
在细胞这个 “万亿级精密工厂” 里,每天都上演着无数 “暗箱操作”—RNA 作为穿梭于细胞核与细胞质的 “信使”,总在悄悄拉拢蛋白质 “盟友”,共同联手达到调控基因表达的目的。想知道这些 “RNA” 如何接头?如何锁定关键 “蛋白分子”?今天就给大家聊聊科研界追踪 RNA -蛋白互作的 “GPS系统”—— RNA pull down 技术!
01.什么是 RNA pull down?
RNA pull down 技术主要是用来捕获特定RNA的相互作用蛋白。简单来说,这是一场 “反向钓鱼” 实验:
1.先人工合成一段 “目标 RNA 探针”(你的 “钓鱼诱饵”),并给它贴个“专属标签”(生物素标记);
2. 把标记好的 RNA 放进细胞裂解液中,等待与之互作的蛋白质 “猎物”自动上钩;
3. 用 “磁珠捕手”(链霉亲和素磁珠)精准捕获 RNA - 蛋白复合物,若待检测目的蛋白明确,通过WB实验检测特定的RNA结合蛋白是否与RNA相互作用!若不明确,则可选择质谱鉴定。
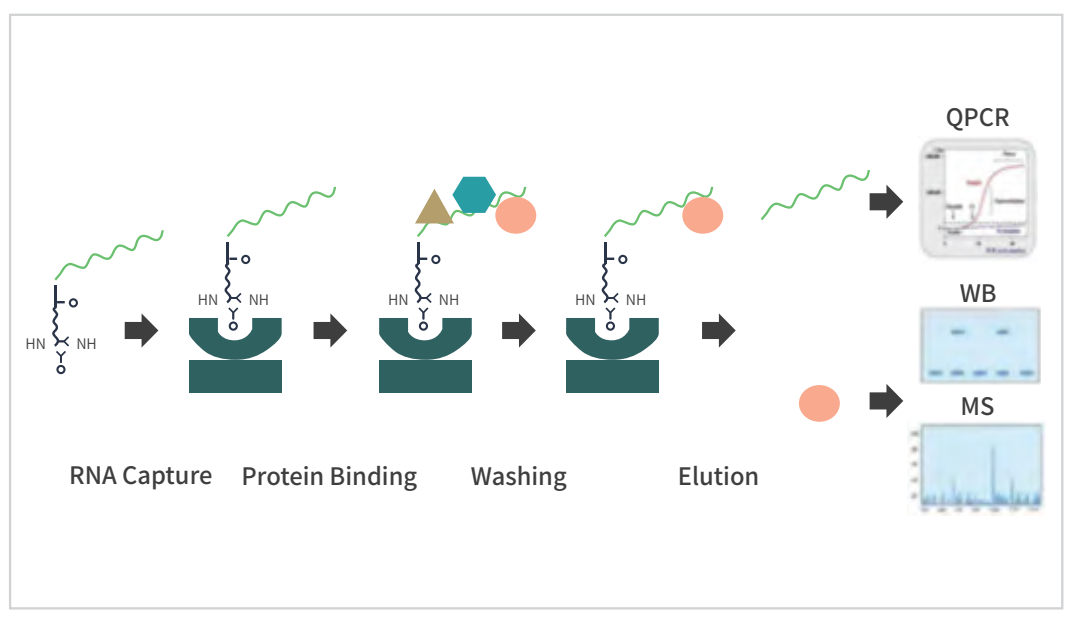
RNA pull down 原理图
02.实验前期准备:科学规划是成功基石
1. 样本选择与处理
细胞或组织样本:需确保RNA完整性与纯度,避免反复冻融。
RNA探针设计:针对目标RNA设计生物素标记的互补探针,需避开二级结构区域。
阴性对照:设置无关序列探针或未标记探针组,排除非特异性结合干扰。
2. 试剂与设备清单
核心试剂:生物素标记探针、链霉亲和素磁珠、RNase抑制剂、裂解缓冲液(含蛋白酶抑制剂)。
仪器准备:磁力架、恒温混匀仪、低温离心机、Western Blot或质谱检测设备。
耗材预冷:全程使用RNase-free枪头、EP管及冰盒操作。
03.方法选择-转录法 or 探针法?
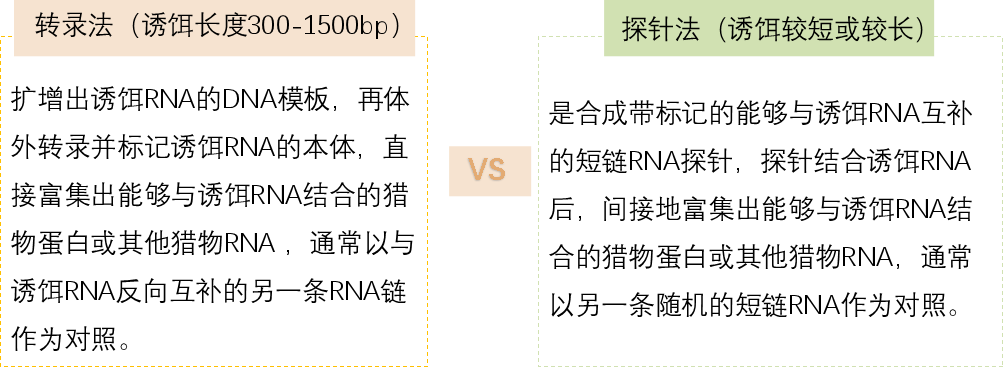
特别短的诱饵比如在60bp以下,可以直接合成带标记的诱饵RNA本体。
探针法和转录法原理上的不同,决定了转录法的特异性和结果的可靠性都要强于探针法,因为合成的RNA探针不能太长,这导致探针可能会非特异性的结合到其他的非诱饵RNA上,最终富集出的猎物也可能不是我们诱饵RNA所特异性结合的。
04.实验步骤:标准化流程保障结果可靠性
1.RNA标记:首先,标记目标RNA分子(通常是合成的in vitro转录RNA),通常使用生物素(biotin)标记。这种标记的RNA片段可以被用作“鱼饵”来捕获与其相互作用的蛋白质。
2.RNA与细胞提取物相互作用:标记的RNA片段被加入细胞或组织的提取物中,使其和与之相互作用的蛋白质结合形成RNA-蛋白质复合物。
3.亲和富集:标记的RNA片段及其相互作用的蛋白质复合物可以通过生物素和亲和纤维素(如琼脂糖琼脂糖珠)的相互作用来富集。这种亲和富集的步骤将RNA-蛋白质复合物从总提取物中分离出来。
4.洗涤: 富集的RNA-蛋白质复合物被多次洗涤,以去除非特异性结合的蛋白质和其他污染物。
5.蛋白质识别: 最后,富集的蛋白质可以通过质谱分析、WB等技术来鉴定和分析。
05.应用场景:解锁RNA研究的更多可能
❖发现新型RNA结合蛋白:捕获特定RNA(mRNA、lncRNA、circRNA等)的相互作用蛋白,揭示未知调控网络。
❖验证已知互作:精准检测目标RNA与候选蛋白(如转录因子、酶)的物理结合,支撑机制研究
❖病毒-宿主互作:追踪病毒RNA劫持宿主蛋白的关键靶点。
❖药物靶点筛选:基于RNA-蛋白复合物设计小分子抑制剂。
06.注意事项:避开这些“坑”,效率翻倍!
➤ 严格控污:全程佩戴手套,使用DEPC水处理耗材,杜绝RNase污染。
➤ 温度敏感:裂解和洗脱步骤需精确控温,避免RNA降解或蛋白失活。
➤ 磁珠处理:洗涤时避免磁珠干涸,每次需充分重悬。
➤ 数据验证:建议结合RIP(RNA结合蛋白免疫沉淀)技术交叉验证结果。
RNA pull down实验在生命科学研究中发挥着重要的作用,为解决更多生物学难题提供了强有力的技术支撑。武汉金开瑞能够提供包括RNA pull down 、RIP、EMSA、双荧光素酶等技术服务,从方案流程设计到技术试验执行,从科研技术服务到成品试剂盒提供,金开瑞实验平台满足您的一切需求,期待与您一起携手合作。
QA:常见问题
1.实验全程如何预防RNA降解?
实验使⽤的所有试剂耗材需经过去RNA酶处理。
2.RNA pull-down⼀定要体外转录合成RNA探针吗?
体外转录只是获得RNA的⼀种⽅式,相⽐化学合成纯度更⾼。所以pull-down实验⼀般是体外转录得到目的RNA。当⽬的RNA序列⼤于2000bp时体外转录就不太容易转录成功,这时我们可以设计合成⼀⼩段⽬的RNA探针,通过探针与⽬的RNA结合,再与蛋⽩结合,便可绕过这个问题。
3.RNA在转录出来后,其OD⼀般都不高,可以使用吗? 如何定量呢?
OD值不⾼可进⾏RNA纯化,即便不纯化在实验中多加⼀些RNA亦可。⽽定量问题⼀般会进⾏琼脂糖凝胶电泳检测,可以根据marker浓度来判断RNA的浓度。也可以⽤仪器测量RNA的浓度,但通过体外转录得到的RNA浓度都能达到2μg/μL以上。并且pulldown实验不需要精确的定量,都会加⼊过量的探针。
4.关于样本处理,细胞或者组织裂解时要不要加蛋白酶抑制剂或RNA酶抑制剂? 还需要进行其他处理吗?操作过程中需要注意什么?
细胞裂解需要加⼊蛋⽩酶和RNA酶抑制剂,最好能够进⾏超声处理。另外裂解蛋⽩的全程尽量在冰上操作。
5.Q5:lncRNA引物设计有什么注意事项? 或者说与普通的引物设计有什么区别?
体外转录扩增的引物只需要在正向引物5’端加⼊T7启动⼦序列即可。
6.质谱鉴定的蛋白主要是依据打分来进行筛选? 这个筛选多少分算有效?
pull-down富集蛋白质谱分析后会剔除不可信蛋⽩,交付的都是可信蛋白,没有明确的打分。需要排序的话⼀般是根据鉴定蛋白特征性肽段的数目作为参考。
7.做lncRNA pulldown + 质谱⼀般都会发现多个互作蛋白对吗? 如何选择哪⼀种蛋白继续研究下去?
不同的RNA结合蛋白数量不等,根据实际鉴定的蛋白进⾏筛选;筛选的原则是根据自己研究的方向或相关功能确定这类蛋白。
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图










